题目内容
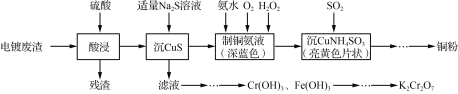
【题目】实验室以电镀废渣(Cr2O3、CuO、Fe2O3及CaO)为原料制取铜粉和K2Cr2O7的主要流程如下:
(1) “酸浸”时,用硫酸而不用盐酸,这是因为______________(从浸取产物的溶解性考虑)。
(2) “制铜氨液”,即制取[Cu(NH3)4]SO4溶液时,采用8 mol·L-1氨水,适量30% H2O2,并通入O2,控制温度为55 ℃。温度不宜过高,这是因为______________________。
(3) “沉CuNH4SO3”时可用如下装置(夹持、加热仪器略):
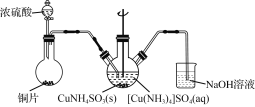
①制取SO2的化学方程式为______________________。
②“沉CuNH4SO3”时,反应液需控制在45 ℃,合适的加热方式是________________。
③反应完成的实验现象是____________________________。
(4) 设计以“Cr(OH)3、Fe(OH)3”的混合物为原料,制取K2Cr2O7的实验方案:将Cr(OH)3、Fe(OH)3的混合物加入烧杯中,加适量的水调成浆状,_________________,冰水洗涤及干燥。
(已知:①碱性条件下,H2O2可将+3价的Cr氧化为CrO42-;酸性条件下,H2O2可将+6价的Cr还原为+3价的Cr;+6价的Cr在溶液pH<5时,主要以Cr2O72-的形式存在;在pH>7时,主要以CrO42-的形式存在。
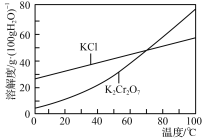
②部分物质溶解度曲线如图所示:
③实验中必须使用的试剂:KOH溶液、10%H2O2溶液、稀盐酸)
【答案】硫酸可将CaO转化为CaSO4渣而除去 温度过高会加速NH3的挥发、加速H2O2的分解、“铜氨液”会分解生成Cu(OH)2(答出一点即可) Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O 45 ℃的水浴加热 上层清液由深蓝色逐渐变为几乎无色 在不断搅拌下加入适量KOH溶液,再加入过量的10% H2O2溶液,维持pH大于7,充分反应后,煮沸(除去过量的H2O2),静置、过滤,滤液用稀盐酸酸化至pH<5,蒸发浓缩、冰浴冷却结晶、过滤
CuSO4+SO2↑+2H2O 45 ℃的水浴加热 上层清液由深蓝色逐渐变为几乎无色 在不断搅拌下加入适量KOH溶液,再加入过量的10% H2O2溶液,维持pH大于7,充分反应后,煮沸(除去过量的H2O2),静置、过滤,滤液用稀盐酸酸化至pH<5,蒸发浓缩、冰浴冷却结晶、过滤
【解析】
电镀废渣(Cr2O3、CuO、Fe2O3及CaO)用硫酸酸浸,残渣为CaSO4 等溶解度不大的物质,溶液中有Cr3+、Cu2+、Fe3+,加适量Na2S 溶液,过滤,滤液中Cr3+、Fe3+,处理生成Fe(OH)3 Cr(OH)3,除去Fe(OH)3,制备K2Cr2O7;滤渣CuS沉淀,采用8 mol·L-1氨水,适量30% H2O2,并通入O2,制取铜氨溶液,通SO2,“沉CuNH4SO3”,同时生成铜粉。
(1) “酸浸”时,用硫酸而不用盐酸,这是因为硫酸可将CaO转化为CaSO4渣而除去。
(2) “制铜氨液”,即制取[Cu(NH3)4]SO4溶液时,温度不宜过高,这是因为 温度过高会加速NH3的挥发、加速H2O2的分解、“铜氨液”会分解生成Cu(OH)2(答出一点即可);
(3) ①铜与浓硫酸加热生成SO2、硫酸铜和水,化学方程式为 Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O 。
CuSO4+SO2↑+2H2O 。
②要控制100℃以下的加热温度,且受热均匀,可选用水浴加热;“沉CuNH4SO3”时,反应液需控制在45 ℃,合适的加热方式是:45 ℃的水浴加热。
③[Cu(NH3)4]SO4溶液呈蓝色,通入SO2 反应生成CuNH4SO3和Cu,反应完成的实验现象是上层清液由深蓝色逐渐变为几乎无色。
(4) 制取K2Cr2O7的实验方案:将Cr(OH)3、Fe(OH)3的混合物加入烧杯中,加适量的水调成浆状,在不断搅拌下加入适量KOH溶液,再加入过量的10% H2O2溶液,维持pH大于7,充分反应后,煮沸(除去过量的H2O2),静置、过滤,滤液用稀盐酸酸化至pH<5,蒸发浓缩、冰浴冷却结晶、过滤,冰水洗涤及干燥。

【题目】类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是( )
已知 | 类推 | |
A | 将Fe加入CuSO4溶液中Fe+Cu2+=Cu+Fe2+ | 将Na加入到CuSO4溶液中2Na+Cu2+=Cu+2Na+ |
B | 向Ca(ClO)2溶液中通入少量CO2 Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2 Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
C | 用惰性电极电解NaCl溶液 2Cl-+2H2O | 用惰性电极电解MgBr2溶液 2Br-+2H2O |
D | 稀盐酸与NaOH溶液反应至中性 H++OH-=H2O | 稀HNO3与Ba(OH)2溶液反应至中性 H++OH-=H2O |
A.AB.BC.CD.D