题目内容
【题目】下列指定反应的离子方程式正确的是( )
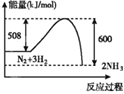
A. 向稀HNO3中滴加NaHSO3溶液:H++HSO![]() ===SO2↑+H2O
===SO2↑+H2O
B. 硫酸铝溶液中加入过量氨水:Al3++3OH-===Al(OH)3↓
C. 向含有2 mol FeI2的溶液中通入2.5 mol Cl2:8I-+2Fe2++5Cl2===10Cl-+4I2+2Fe3+
D. 用酸性高锰酸钾标准溶液滴定草酸:2MnO![]() +16H++5C2O
+16H++5C2O![]() ===2Mn2++10CO2↑+8H2O
===2Mn2++10CO2↑+8H2O
【答案】C
【解析】
A.向稀HNO3中滴加Na2SO3溶液,二者发生氧化还原反应,正确的离子反应为:2NO3-+3SO32-+2H+═3SO42-+2NO↑+H2O,故A错误;
B.硫酸铝溶液中加入过量氨水,二者反应生成氢氧化铝沉淀和硫酸铵,一水合氨为弱碱,不能拆开,应写化学式,正确的离子方程式:Al3++3NH3·H2O═Al(OH)3↓+3NH4+,故B错误;
C.向含有2molFeI2的溶液中通入2.5molCl2,4molI-消耗2molCl2,剩余的0.5mol氯气氧化1mol亚铁离子,该反应的离子方程式为:8I-+2Fe2++5Cl2=10Cl-+4I2+2Fe3+,故C正确;
D.用酸性高锰酸钾标准溶液滴定草酸,草酸是弱酸,应写化学式,正确的离子方程式为:2MnO4-+6H++5H2C2O4=2Mn2++10CO2↑+8H2O,故D错误。
故选C。

 计算高手系列答案
计算高手系列答案【题目】某同学向SO2和Cl2的混合气体中加入品红溶液,振荡,溶液褪色,将此无色溶液分成三份,依次进行实验,实验操作和实验现象记录如下:
序号 | |||
实验操作 |
|
|
|
实验现象 | 溶液不变红,试纸不变蓝 | 溶液不变红,试纸褪色 | 生成白色沉淀 |
下列实验分析中,不正确的是
A. ①说明Cl2被完全消耗
B. ②中试纸褪色的原因是:SO2 + I2 + 2H2O == H2SO4 + 2HI
C. ③中若将BaCl2溶液换成Ba(NO3)2溶液,也能说明SO2被Cl2氧化为SO42
D. 实验条件下,品红溶液和SO2均被氧化