题目内容
【题目】研究化学反应时,既要考虑物质变化与能量变化,又要关注反应的快慢与限度。回答下列问题:
(1)NH3还原NO是重要的烟气脱硝技术,其反应过程与能量关系如图所示
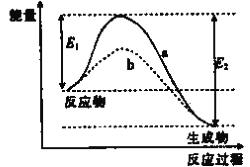
①上图中因为改变了反应条件,反应的活化能:b_______(填“>”“<"或“=”)a。
②脱硝反应的热化学方程式可表示为反应物→生成物△H=______(用E1、E2的代数式表示)。
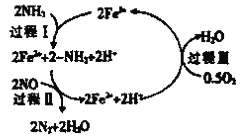
③研究发现,一定条件下的脱硝反应过程可能如图所示,根据氧化还原反应中物质的作用,NO为_______剂,脱硝总反应的化学方程式为_______________。
(2)一定温度下,将不同物质的量的H2O(g)和CO分别通入容积为1L的恒容密容器中,进行反应H2O(g)+CO(g)![]() CO2(g)+H2(g),得到如表所示的三组数据
CO2(g)+H2(g),得到如表所示的三组数据
试验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡时间/min | ||
H2O(g) | CO(g) | CO(g) | H2(g) | |||
1 | 650 | 2.0 | 4.0 | 3.0 | 1.0 | 5 |
2 | 900 | 1.0 | 2.0 | 1.8 | 0.2 | 4 |
3 | 900 | a | b | c | d | t |
①4mim内,实验2中v(CO2)=______; 900℃时,反应的平衡常数为______;降低温度时,平衡常数会________(填“增大”“减小”或“不变”)。
②650℃时,若在此容器中充入2.0 mol H2O(g)、1.0molCO(g)、1.0 mol CO2(g)和 xmol H2(g),要使反应在开始时向正反应方向进行,则x应满足的条件是__________。
若a=2.0.b=1.0,则平衡时实验2中H2O(g)和实验3中CO(g)的转化率(a)的关系为a(H2O) _______ (填“>”<”成=”)a(CO)。
【答案】< -(E2-E1) 还原 4NH3+4NO+O2![]() 4N2+6H2O 0.05mol/L-1·min-1
4N2+6H2O 0.05mol/L-1·min-1 ![]() 增大 0≤x<
增大 0≤x<![]() =
=
【解析】
(1)①催化剂可降低反应活化能;
②E1是正反应活化能,E2是逆反应活化能,正反应△H=正反应活化能-逆反应活化能;
③根据化合价去分析氧化剂、还原剂以及氧化还原方程式配平;
(2)①反应速率公式![]() ,再根据速率比等于化学计量数之比求答;根据1,2组数据,求出平衡常数,找出平衡常数与温度的关系;
,再根据速率比等于化学计量数之比求答;根据1,2组数据,求出平衡常数,找出平衡常数与温度的关系;
②平衡常数计算中代入的必然是平衡时的浓度,而浓度商则不一定是平衡时的浓度。浓度商小于平衡常数时反应向右进行,等于平衡常数时达平衡,大于平衡常数时反应向左进行。
③分别列出三段式比较进行分析。
(1)①由图像可知活化能降低,故答案应为:<;
②由图,反应物能量大于生成物能量,故反应是放热反应,用-表示放热,△H=正反应活化能-逆反应活化能,故答案应为:-(E2-E1);
③NO在反应中化合价降低,作氧化剂;由图2可知反应物为NH3、NO和O2,生成物为N2和H2O,所以化学方程式为4NH3+4NO+O2![]() 4N2+6H2O,故答案应为:氧化;4NH3+4NO+O2
4N2+6H2O,故答案应为:氧化;4NH3+4NO+O2![]() 4N2+6H2O;
4N2+6H2O;
(2)①由方程式可知v(CO2):v(H2)=1:1,根据图表计算v(H2)=0.2mol/L÷4min=0.05mol/L-1·min-1,故v(CO2)=0.05mol/L-1·min-1,根据平衡常数计算公式,900℃平衡常数为![]()
![]() ,同理可计算650℃平衡常数为
,同理可计算650℃平衡常数为![]() ,故降低温度平衡常数增大。故答案应为:0.05mol/L-1·min-1;
,故降低温度平衡常数增大。故答案应为:0.05mol/L-1·min-1;![]() ;增大;
;增大;
②计算此时此刻的![]() ,化学平衡正向移动,所以Q<平衡常数k,所以
,化学平衡正向移动,所以Q<平衡常数k,所以![]() ,
,![]() ,由题x应≥0。故答案应为:0≤x<
,由题x应≥0。故答案应为:0≤x<![]() ;
;
③根据平衡常数和三段式分别求出实验2中H2O(g)的转化率为20%。实验3中CO(g)的转化率为y,则
H2O(g)+CO(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
起始浓度(mol/L) 2 1 0 0
转化浓度(mol/L) y y y y
平衡浓度(mol/L)2-y 1-y y y
则![]()
解得y=0.2
即实验3中CO(g)的转化率为20%。故答案应为:=。

 阅读快车系列答案
阅读快车系列答案