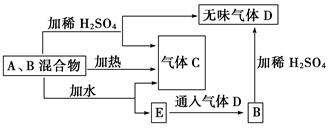
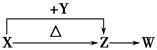题目内容
欲测定含少量氯化钠的小苏打固态样品中NaHCO3的质量分数可采用以下四种方法。
方法一:

方法二:
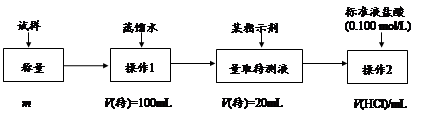
方法三:
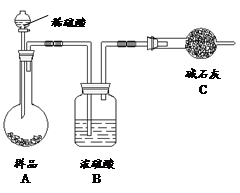
方法四:不使用化学试剂,使用实验室常用仪器
按要求回答下列问题:
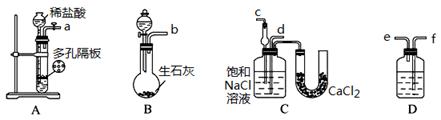
(1)方法一:加入足量的试剂A (填写A的化学式)可将HCO3-离子转化为沉淀并称重。操作1、2、3、4的名称依次是溶解、 、洗涤和 ;
(2)方法二:在操作1中所用到的玻璃仪器中,除了烧杯、玻璃棒、胶头滴管外,还需要的用到的是 ,在操作2中应选择的指示剂是 ;
(3)在方法二中计算该样品中NaHCO3的质量分数为 [用流程图中的数据m、V(HCl) 填写有关的表达式];
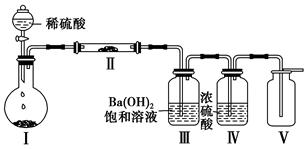
(4)在方法三中:根据所用的实验装置,除了称量试样质量外,还需测定的实验数据是 ;
(5)仔细分析方法三中的实验装置,若由此测得的数据来计算实验结果,则有可能偏高也有可能偏低,偏高的原因可能是 ,偏低的原因可能是 (均文字简述);
(6)方法四的实验原理是: (用化学方程式表示)。
方法一:

方法二:
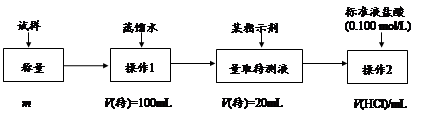
方法三:

方法四:不使用化学试剂,使用实验室常用仪器
按要求回答下列问题:
(1)方法一:加入足量的试剂A (填写A的化学式)可将HCO3-离子转化为沉淀并称重。操作1、2、3、4的名称依次是溶解、 、洗涤和 ;
(2)方法二:在操作1中所用到的玻璃仪器中,除了烧杯、玻璃棒、胶头滴管外,还需要的用到的是 ,在操作2中应选择的指示剂是 ;
(3)在方法二中计算该样品中NaHCO3的质量分数为 [用流程图中的数据m、V(HCl) 填写有关的表达式];
(4)在方法三中:根据所用的实验装置,除了称量试样质量外,还需测定的实验数据是 ;
(5)仔细分析方法三中的实验装置,若由此测得的数据来计算实验结果,则有可能偏高也有可能偏低,偏高的原因可能是 ,偏低的原因可能是 (均文字简述);
(6)方法四的实验原理是: (用化学方程式表示)。
(1)Ca(OH)2或 Ba(OH)2(写名称不给分);过滤 、干燥(烘干)(每空1分,共3分)
(2)100 mL容量瓶, 甲基橙 (每空1分,共2分)
(3)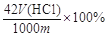 (2分)
(2分)
(4)装有碱石灰的干燥管在实验前后的质量 (2分)
(5)碱石灰可能还会吸收空气中的水蒸气和CO2气体
 装置内会留存部分CO2气体 (每空2分,共4分)
装置内会留存部分CO2气体 (每空2分,共4分)
(6)2NaHCO3 Na2CO3+CO2↑+H2O
(2)100 mL容量瓶, 甲基橙 (每空1分,共2分)
(3)
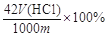 (2分)
(2分)(4)装有碱石灰的干燥管在实验前后的质量 (2分)
(5)碱石灰可能还会吸收空气中的水蒸气和CO2气体
 装置内会留存部分CO2气体 (每空2分,共4分)
装置内会留存部分CO2气体 (每空2分,共4分)(6)2NaHCO3 Na2CO3+CO2↑+H2O
试题分析:(1)与HCO3-反应钠产生沉淀的试剂有Ca(OH)2或 Ba(OH)2,二者选其一即可;操作1、2、3、4的名称依次是溶解、过滤、洗涤、干燥;
(2)方法二中还需100mL的容量瓶;酚酞的变色范围是8~10,未滴定完已变色,不可用;滴定终点时溶液偏酸性,应使用甲基橙作指示剂,溶液由黄色变为橙色;
(3)由所用盐酸的体积可计算出20mL的待测液中碳酸氢钠的物质的量,原液是待测液的5倍,所以,样品中NaHCO3的质量分数为V(HCl)×10-3×0.100×5×84/m×100%=
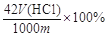
(4)方法三利用产生二氧化碳的质量来计算碳酸氢钠的质量分数,所用需要称量装有碱石灰的干燥管在实验前后的质量;
(5)偏高的原因是碱石灰还会吸收空气中的二氧化碳和水使质量增大;偏低的原因是装置中会有残留的二氧化碳未被吸收;
(6)不用其他化学试剂,就只能是碳酸氢钠的受热分解了,利用固体反应前后的质量差,计算碳酸氢钠的质量分数,化学方程式是2NaHCO3
 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
练习册系列答案
 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目