题目内容
【题目】如图所示两个装置中,溶液的体积均为1 L,浓度均为0.1 mol·L-1,工作一段时间后,测得电路中均通过了0.02 mol e-,则下列叙述中不正确的是
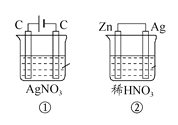
A. 相同状况下,产生气体总体积:①<②
B. 接通电路前溶液的pH:①>②
C. 接通电路后溶液的pH:①<②
D. 析出固体质量:①>②
【答案】C
【解析】试题分析:①为电解池,两电极为惰性电极,通过0.02 mol e-,阴极析出银0.02mol,质量为2.16g,同时阳极生成氧气0.005mol和0.02mol H+;②为原电池,锌为负极,锌不断地溶解,银为正极,通过了0.02 mol e-,正极的电极反应式为NO3-+3e-+4H+=NO+2H2O,NO的物质的量为0.0067mol,消耗0.027mol H+,溶液中还剩余0.073mol H+。A. 相同状况下,产生气体总体积①<②,A正确;B. 接通电路前硝酸银溶液中的氢离子浓度肯定小于0.1 mol·L-1的硝酸,所以溶液的pH①>②,B正确;C. 接通电路后,硝酸银溶液中生成的氢离子的物质的量小于硝酸中剩余的氢离子,两溶液体积相等,所以溶液的pH ①>②,C不正确;D. 析出固体质量①>②,D正确。本题选C。

练习册系列答案
相关题目