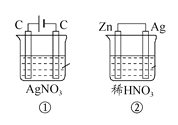
��Ŀ����
����Ŀ��I.��ҵ�����÷�ӦZnFe2 ��C2O4��3��6H2O![]() ZnFe2O4+2CO2��+4CO��+6H2O�Ʊ�ZnFe2O4��
ZnFe2O4+2CO2��+4CO��+6H2O�Ʊ�ZnFe2O4��
��1��ZnFe2O4��Fe�Ļ��ϼ�Ϊ___________��
��2���÷�Ӧ�л�ԭ������________���ѧʽ����ÿ����1mol ZnFe2O4��ת�Ƶĵ�����Ϊ________��
��.��pH=l��ij��ҺX�н�����NH4+��Al3+��Ba2+��Fe2+��Fe3+��CO32-��SO42-��Cl-��NO3-�е�һ�ֻ��֣�����ˮ�ĵ��뼰���ӵ�ˮ�⣩��ȡ����Һ��������ʵ�飬ʵ�������ͼ��
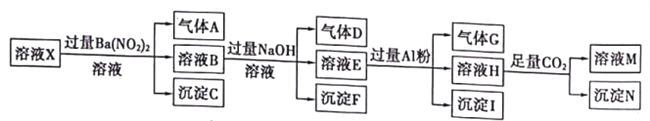
��֪��NO3-+Al+OH-+H2O��NH4++[Al��OH��4]-
��1����ҺX�г�H+�⣬һ�����ڵ�������_________________��
��2��д�����ɳ���N�����ӷ���ʽ_________________��
��3����ȡԭ��ҺX����ֱ�Ӽ���AgNO3��Һ������ɫ��������ȷ������Һ��һ������Cl-������Ϊ����˵���Ƿ������_______������������������������������____________��
���𰸡� +3 CO 4NA��2.408��1024 NH4+��Fe2+��SO42- Al��OH��4]-+ CO2=Al��OH��3��+HCO3- �� �������к���SO42-������AgNO3��Һ�����Ag2 SO4����ɫ�������ʲ���ȷ���Ƿ���Cl-
�������� I.��1��. ZnFe2O4��п�Ļ��ϼ�+2�ۣ���Ԫ�ػ��ϼ�-2�ۣ�����Ԫ�صĻ��ϼ�Ϊ+x�ۣ���ϻ��ϼ۴�����Ϊ0������õ�Fe�Ļ��ϼۣ�+2+x��2+��-2����4=0��x=+3���ʴ�Ϊ��+3��
��2��. ��ҵ�����÷�ӦZnFe2 ��C2O4��3��6H2O![]() ZnFe2O4+2CO2��+4CO��+6H2O�Ʊ�ZnFe2O4����Ӧ��������Ԫ�ػ��ϼ���+2�۱�Ϊ+3�ۣ�̼Ԫ�ػ��ϼ۴�+3�۱�Ϊ+4�ۺ�+2�ۣ���ԭ����Ϊ�� CO��ÿ����1mol ZnFe2O4��̼Ԫ�ػ��ϼ۴�+3�۱�Ϊ+2�������͵õ����ӣ����ݷ���ʽ��֪��ÿ����1mol ZnFe2O4��������4molCO��ת�Ƶ��ӵ����ʵ�����4mol��ת�Ƶĵ�������4NA��2.408��1024���ʴ��ǣ�CO��4NA��2.408��1024��
ZnFe2O4+2CO2��+4CO��+6H2O�Ʊ�ZnFe2O4����Ӧ��������Ԫ�ػ��ϼ���+2�۱�Ϊ+3�ۣ�̼Ԫ�ػ��ϼ۴�+3�۱�Ϊ+4�ۺ�+2�ۣ���ԭ����Ϊ�� CO��ÿ����1mol ZnFe2O4��̼Ԫ�ػ��ϼ۴�+3�۱�Ϊ+2�������͵õ����ӣ����ݷ���ʽ��֪��ÿ����1mol ZnFe2O4��������4molCO��ת�Ƶ��ӵ����ʵ�����4mol��ת�Ƶĵ�������4NA��2.408��1024���ʴ��ǣ�CO��4NA��2.408��1024��
��. pH=1����ҺΪǿ������Һ����ǿ������Һ��һ���������CO32-������������ᱵ���ɳ�������ó���CΪBaSO4��˵����Һ�к���SO42-����������A����Aֻ����NO��˵����Һ�к��л�ԭ�����ӣ���һ��ΪFe2+����ҺB�м������NaOH��Һ������Fֻ��ΪFe(OH)3����������D����DΪNH3��˵����Һ�к���NH4+����ҺE�м��������Al����������֪����ʽNO3-+Al+OH-+H2O��NH4++[Al��OH��4]-������ҺH�к���[Al��OH��4]-��ͨ��CO2���壬���ɳ���N����NΪAl��OH��3��˵����Һ�в�һ������Al3+���ӣ��ٸ������ӹ���֪ʶ����Һ�к���Fe2+���ӣ���һ������NO3-����һ������SO42-���ӣ���һ������Ba2+������ȷ���Ƿ��е�����Fe3+��Cl-���Դ˽��н����
��1��.��������������֪����ҺX�г���H+�⣬һ�����ڵ���������. NH4+��Fe2+��SO42-���ʴ��ǣ�. NH4+��Fe2+��SO42-��
��2��.��ҺH��ͨ������CO2������ҺH�е�[Al��OH��4]-��Ӧ����Al(OH)3��������Ӧ�����ӷ���ʽ�ǣ�Al��OH��4]-+ CO2=Al��OH��3��+HCO3-���ʴ��ǣ�Al��OH��4]-+ CO2=Al��OH��3��+HCO3-��
��3��. ȡԭ��ҺX����ֱ�Ӽ���AgNO3��Һ������ɫ����������ҺX��һ������SO42-������Ag����Ӧ����Ag2SO4����ɫ�������ʲ���ȷ��X��Һ���Ƿ���Cl�����ʴ��ǣ������������к���SO42-������AgNO3��Һ�����Ag2 SO4����ɫ�������ʲ���ȷ���Ƿ���Cl-��

����Ŀ��һ���¶�ʱ��1L�ܱ������з�����Ӧ��2SO2(g)+O2(g) ![]() 2SO3(g) ��H=��196kJ/mol��������
2SO3(g) ��H=��196kJ/mol��������
��Ӧʱ��/min | n(SO2)/mol | n(O2)/mol |
0 | 2 | 1 |
5 | 1��2 | |
10 | 0��4 | |
15 | 0��8 |
����˵������ȷ����
A. ��Ӧ��ǰ5min��ƽ������Ϊv (SO2)=0��08mol��L1 min1
B. �����¶Ȳ��䣬��ƽ�����������ٳ���0��2molSO2��0��1molO2ʱ��v (��)�� v (��)
C. ���������������䣬����ʼʱ�������г���2molSO3����ƽ��ʱ����78��4kJ������
D. ��ͬ�¶��£���ʼʱ�������г���1��5mol SO3����ƽ��ʱSO3��ת����Ϊ40%