题目内容
9.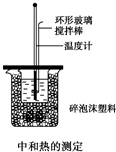 50mL 0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
50mL 0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题:(1)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式:NaOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol.
(2)倒入NaOH溶液的正确操作是 (从下列选出)C
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)大烧杯如不盖硬纸板,求得的中和热数值偏小(填“偏大”“偏小”“无影响”).
分析 (1)根据酸碱中和反应生成1mol液态水时放出57.3kJ的热量书写热化学方程式;
(2)根据硫酸和氢氧化钠反应反应迅速剧烈,并且释放大量热,一次性快速倒入可以减少热量散发而引来的误差;
(3)不盖硬纸板,会有一部分热量散失.
解答 解:(1)稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,稀硫酸和氢氧化钠稀溶液分别是强酸、强碱,则反应的热化学方程式为:NaOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol;
故答案为:NaOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol;
(2)根据硫酸和氢氧化钠反应反应迅速剧烈,并且释放大量热,一次性快速倒入可以减少热量散发而引来的误差,故选:C;
(3)大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小,故答案为:偏小.
点评 本题主要考查了中和热的测定,注意保温工作是实验成功的关键,题目难度不大.

练习册系列答案
相关题目
19.实验室使用容量瓶来配置一定体积、一定浓度的溶液.下列有关容量瓶的叙述错误的是( )
| A. | 容量瓶上标有容量瓶的规格和温度 | |
| B. | 容量瓶瓶颈只有一个刻度线 | |
| C. | 容量瓶不能用作溶解的容器 | |
| D. | 为防止热溶液蒸发时损失水分,应立即将热溶液转移到容量瓶中 |
14.下列物质与水混合时,不发生氧化还原反应的是( )
| A. | NO2 | B. | Na2O2 | C. | Na2O | D. | Cl2 |
1.乳酸的结构简式是CH3-CH(OH)-COOH,下列有关乳酸的说法中正确的是( )
| A. | 乳酸中不含羟基 | |
| B. | 乳酸与足量NaOH溶液反应时物质的量之比为1:2 | |
| C. | 乳酸可以发生消去反应 | |
| D. | 乳酸与足量钠反应时物质的量之比为1:1 |
18.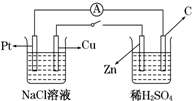 如图所示,将两烧杯用导线如图相连,Pt、Cu、Zn、C分别为四个电极,当闭合开关后,以下叙述正确的是( )
如图所示,将两烧杯用导线如图相连,Pt、Cu、Zn、C分别为四个电极,当闭合开关后,以下叙述正确的是( )
 如图所示,将两烧杯用导线如图相连,Pt、Cu、Zn、C分别为四个电极,当闭合开关后,以下叙述正确的是( )
如图所示,将两烧杯用导线如图相连,Pt、Cu、Zn、C分别为四个电极,当闭合开关后,以下叙述正确的是( )| A. | Cu极为原电池负极 | |
| B. | Cu极附近OH-浓度增大 | |
| C. | 电子流向是由C极流向Pt极 | |
| D. | 当C极上有4 mol电子转移时,Pt极上有1 mol O2生成 |
19.化学已深入我们的生活,下列说法不正确的是( )
| A. | 醋酸可除水垢 | |
| B. | 甘油可做护肤保湿剂 | |
| C. | 包装用的聚氯乙烯属于烃 | |
| D. | 酯类物质是形成水果香味的主要成分 |
 盐泥是氯碱工业中的废渣,主要含有镁、铁、铝、钙等的硅酸盐和碳酸盐.实验室以盐泥为原料制取MgSO4•7H2O的流程如下:[29g盐泥]$→_{②H_{2}SO_{4}调pH=1-2}^{①水,调成泥浆}$$→_{④过滤}^{③煮沸}$[滤液Ⅰ]$→_{⑥煮沸,趁热}^{⑤加NaClO,pH=5~6}$[滤液Ⅱ]→产品
盐泥是氯碱工业中的废渣,主要含有镁、铁、铝、钙等的硅酸盐和碳酸盐.实验室以盐泥为原料制取MgSO4•7H2O的流程如下:[29g盐泥]$→_{②H_{2}SO_{4}调pH=1-2}^{①水,调成泥浆}$$→_{④过滤}^{③煮沸}$[滤液Ⅰ]$→_{⑥煮沸,趁热}^{⑤加NaClO,pH=5~6}$[滤液Ⅱ]→产品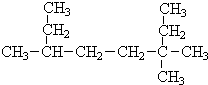 3,3,6-三甲基辛烷
3,3,6-三甲基辛烷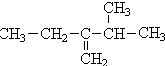 3-甲基-2-乙基-1-丁烯
3-甲基-2-乙基-1-丁烯 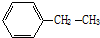 乙苯
乙苯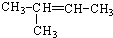 ;
; 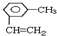 .
.