题目内容
20.促进生态文明,保护生态环境,是实现“中国梦”的重要组成部分.①用明矾处理废水中细小悬浮颗粒的方法属于a(填字母).
a.混凝法 b.中和法 c.氧化还原法
②pH<5.6的雨水称为酸雨,向燃煤中加入石灰石作为脱硫剂,可以减少煤燃烧时产生的SO2.发生反应的化学方程式为2CaCO3+2SO2+O2═2CaSO4+2CO2.燃煤产生的CO2用NH3处理可生产多种化工产品.用氨水吸收CO2可制得碳铵(NH4HCO3),写出该反应的化学方程式CO2+H2O+NH3=NH4HCO3.用液氨与CO2反应可制备尿素[CO(NH2)2].尿素和碳铵这两种氮肥中,氮元素的质量分数较高的是尿素.煤的气化和液化是实现能源清洁化的重要途径.水煤气中CO和H2在加热、加压和催化剂存在条件下可以合成液体燃料(CH3OH),该反应的化学方程式为[CO(NH2)2]CO+2H2=CH3OH.
③选择环保的装修材料可以有效地减少居室污染.劣质胶合板释放的主要污染物是甲醛.
分析 ①明矾净水是利用铝离子水解生成的氢氧化铝胶体具有吸附悬浮杂质的作用净水;
②pH<5.6的雨水称为酸雨;石灰石的主要成分是碳酸钙,吸收SO2生成CaSO4;氨气、二氧化碳、水反应生成碳酸氢铵;根据化合物中元素的质量分数=$\frac{相对原子质量×原子个数}{相对分子质量}$×100%,进行分析解答,根据信息“CO和H2在加热和催化剂条件下反应,可以制得液体燃料甲醇(CH3OH)”写出化学反应式;
③劣质胶合板释放的主要污染物是甲醛,释放后造成室内污染.
解答 解:①明矾是硫酸铝钾的晶体,净水作用是利用其溶解后的溶液中,铝离子水解生成的氢氧化铝胶体具有吸附悬浮杂质的作用,所以用来净水,属于混凝法;
故答案为:a;
②pH<5.6的雨水称为酸雨,石灰石的主要成分是碳酸钙,吸收SO2生成CaSO4,配平得反应的化学方程式为2CaCO3+2SO2+O2═2CaSO4+2CO2↑;氨气、二氧化碳、水反应生成碳酸氢铵:CO2+H2O+NH3=NH4HCO3;尿素的相对分子质量为60,尿素中氮元素的质量分数是$\frac{14×2}{60}$×100%≈46.7%;
碳铵的相对分子质量为:$\frac{14}{79}$×100%=17.7%;
所以氮元素的质量分数较高的是尿素,CO和H2在加热和催化剂条件下反应,可以制得液体燃料甲醇(CH3OH),故方程式为:[CO(NH2)2]CO+2H2=CH3OH,故答案为:5.6;2CaCO3+2SO2+O2═2CaSO4+2CO2;CO2+H2O+NH3=NH4HCO3;尿素;[CO(NH2)2]CO+2H2=CH3OH;
③甲醛是劣质胶合板释放的主要污染物,造成室内污染,故答案为:甲醛.
点评 本题考查环境污染及治理,为高频考点,侧重于化学与生活、生产、能源与环境的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大,注意相关基础知识的积累.

 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案| A. | 食醋用作调味剂 | B. | 碳酸钙用作补钙剂 | ||
| C. | 食品包装袋中填充氮气防腐 | D. | 用大量防腐剂保存牛奶 |
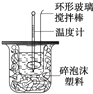 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:①用量筒量取50mL 0.25mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL 0.55mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度.回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ/mo(l):$\frac{1}{2}$H2SO4(aq)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ•mol-1.
(2)倒入NaOH溶液的正确操作是:C. (从下列选项中选出).
A.沿玻璃棒缓慢倒入 B.分三次少量倒入C.一次迅速倒入
(3)实验数据如下表:
①请填写下表中的空白:
| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均 值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)a、b、c.
a.实验装置保温、隔热效果差b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中.
| A. | AlCl3与过量NaOH溶液反应生成AlO2-,则与过量NH3•H2O也生成AlO2- | |
| B. | Mg可以常温下被氧气氧化,Al也可以常温下被氧气氧化 | |
| C. | Fe与Cl2反应生成FeCl3,则与I2反应可生成FeI3 | |
| D. | Fe与S能反应生成FeS,则Cu与S也能反应生成CuS |
| A. | 用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH- | |
| B. | 以石墨作电极电解AlCl3溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| C. | FeSO4溶液与稀H2SO4溶液、双氧水混合:2Fe2++H2O2+2H+═2Fe3++2H2O | |
| D. | NaHSO4溶液与足量Ba(OH)2溶液混合:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
| A. | 1mol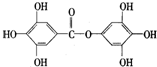 最多能与8molNaOH发生反应 最多能与8molNaOH发生反应 | |
| B. | 甲苯既能跟溴水反应又能跟酸性高锰酸钾溶液反应 | |
| C. | 向苯酚钠溶液中通入少量的CO2气体,发生反应的离子方程式为: 2 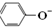 +H2O+CO2→2 +H2O+CO2→2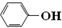 +CO${\;}_{3}^{2-}$ +CO${\;}_{3}^{2-}$ | |
| D. | 1mol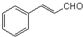 最多能和4molH2发生反应 最多能和4molH2发生反应 |
| A. | 盐酸+氢氧化钠溶液 | B. | 氯化钠溶液+硫酸钾溶液 | ||
| C. | 硫酸钠溶液+氢氧化钡溶液 | D. | 稀硫酸+碳酸钠溶液 |
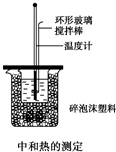 50mL 0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
50mL 0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题: