题目内容
【题目】在标准状况下,有四种气体:①6.72 L CH4;②3.01×1023个HCl分子;③13.6g H2S;④0.2 mol NH3。下列有关比较中正确的是
A.体积大小:②>③>①>④
B.质量大小:②>③>④>①
C.氢原子数目多少:④>①>③>②
D.摩尔质量的大小:④>②>③>①
【答案】A
【解析】
A.先计算各种气体的物质的量,利用n=![]() 可知:气体的物质的量越多,气体的体积越大比较;
可知:气体的物质的量越多,气体的体积越大比较;
B.根据m=nM计算,然后比较大小;
C.根据氢原子的物质的量等于分子的物质的量与分子中含有的H原子数目的乘积n(H),再根据N=nNA比较;
D.根据摩尔质量与物质相对分子质量的关系计算。
在标准状况下:①6.72L CH4,n(CH4)=6.72L÷22.4L/mol=0.3mol;
②3.01×1023个HCl分子,n(HCl)= 3.01×1023÷6.02×1023/mol=0.5mol;
③13.6g H2S,n(H2S)=13.6g÷34g/mol=0.4mol,
④0.2mol NH3。
A.根据n=![]() 可知气体的物质的量越多,气体的体积越大,所以气体体积由大到小的顺序为②>③>①>④,A正确;
可知气体的物质的量越多,气体的体积越大,所以气体体积由大到小的顺序为②>③>①>④,A正确;
B.根据m=nM可知m(CH4)=0.3mol×16g/mol=4.8g;②m(HCl)=0.5mol×36.5g/mol=18.25g;m(H2S)=13.6g;m(NH3)=0.2mol×17g/mol=3.4g,则四种气体的质量由大到小的顺序为:②>③>①>④,B错误;
C.根据氢原子的物质的量的多少判断,物质的量越多,原子个数越多,0.3molCH4含有1.2molH,0.5mol含有0.5molH,0.4molH2S含有0.8molH,0.2molNH3含有0.6molH,则氢原子个数大小为①>③>④>②,C错误;
D.当单位为g/mol时,物质的摩尔质量等于气体的相对分子质量,则四种气体的摩尔质量由大到小的顺序为②>③>④>①,D错误;
故合理选项是A。

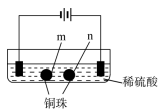
【题目】用石墨电极完成下列电解实验
实验一 | 实验二 | |
装置 |
|
|
现象 | a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 | 两个石墨电极附近有气泡产生;n处有气泡产生…… |
下列对实验现象的解释或推测不合理的是( )
A. a、d处:2H2O+2e-=H2↑+2OH- B. b处:2Cl--2e-=Cl2↑
C. c处发生了反应:Fe-2e-=Fe2+ D. 根据实验一的原理,实验二中m处能析出铜