题目内容
【题目】已知:H2(g)+Cl2(s)2HCl(g)△H=+akJ/mol H2(g)+Cl2(g)2HCl(g)△H=﹣dkJ/mol ![]() 且a、b、c、d均大于零,则下列说法正确的是( )
且a、b、c、d均大于零,则下列说法正确的是( )
A.断开1molH﹣Cl键所需的能量为﹣a﹣b﹣c
B.b>c,则氢气分子具有的能量高于氯气分子具有的能量
C.Cl2(s)=Cl2(g)△H=+(a+d)kJmol﹣1
D.向1molCl2(g)中通入1molH2(g),发生反应时放热dkJ
【答案】C
【解析】解:A、断裂化学键应按照气体计算,反应焓变=反应物总键能﹣生成物总键能计算分析,断开1molH﹣Cl键所需的能量为(d+b+c)× ![]() KJ,故A错误; B、b>c>说明氢气稳定,能量也高越活泼,氢气分子具有的能量低于氯气分子具有的能量,故B错误;
KJ,故A错误; B、b>c>说明氢气稳定,能量也高越活泼,氢气分子具有的能量低于氯气分子具有的能量,故B错误;
C、依据热化学方程式和盖斯定律计算分析,①H2(g)+Cl2(s)2HCl(g)△H=+akJ/mol
②H2(g)+Cl2(g)2HCl(g)△H=﹣dkJ/mol;
①﹣②得到Cl2(s)=Cl2(g)△H=+(a+d)kJmol﹣1 , 故C正确;
D、反应是可逆反应不能进行彻底,向1molCl2(g)中通入1molH2(g),发生反应时放热小于dkJ,故D错误;
故选C.
【考点精析】解答此题的关键在于理解反应热和焓变的相关知识,掌握在化学反应中放出或吸收的热量,通常叫反应热.

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案【题目】硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业.从硼镁泥中提取MgSO47H2O的流程如下: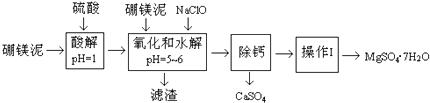
根据题意回答问题:
(1)实验中需用1mol/L的硫酸800mL,若用98%的浓硫酸(ρ=1.84g/mL)来配制,量取浓硫酸时,需使用的量筒的规格为
A.10mL
B.20mL
C.50mL
D.100mL
(2)加入的NaClO可与Mn2+反应:Mn2++ClO﹣+H2O→MnO2↓+2H++Cl﹣ , 还有一种离子也会被NaClO氧化,该反应的离子方程式为 .
(3)滤渣的主要成份除含有Fe(OH)3、Al(OH)3外,还有 .
(4)在“除钙”前,需检验滤液中Fe3+是否被除尽,简述检验方法 .
(5)已知MgSO4、CaSO4的溶解度如下表:
温度(℃) | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤 . “操作I”是将滤液继续蒸发浓缩,冷却结晶, , 便得到了MgSO47H2O.
(6)实验中提供的硼镁泥共100g,得到的MgSO47H2O为172.2g,则MgSO47H2O的产率为 .