题目内容
【题目】依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题: 
(1)电极X的材料是 , 电解质溶液Y是;
(2)银电极为电池的极,发生的电极反应为 X电极上发生的电极反应为 .
(3)外电路中的电子是从电极流向电极.
【答案】
(1)Cu; AgNO3
(2)正;2Ag++2e﹣═2Ag; Cu﹣2e﹣═Cu2+
(3)Cu; Ag
【解析】解:(1)由反应2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)可知,在反应中,Cu被氧化,失电子,应为原电池的负极,所以X电极材料是Cu,Ag+在正极上得电子被还原,电解质溶液为AgNO3 ,
故答案为:Cu;AgNO3;(2)正极为活泼性较Cu弱的Ag,Ag+在正极上得电子被还原,电极反应为2Ag++2e﹣═2Ag,X(铜)电极失电子发生氧化反应,电极反应为Cu﹣2e﹣═Cu2+,
故答案为:正极; 2Ag++2e﹣=2Ag;Cu﹣2e﹣═Cu2+;(3)电子从负极Cu沿导线流向正极Ag,
故答案为:Cu;Ag.
(1)根据电池反应式知,失电子化合价升高的金属作负极,不如负极活泼的金属或导电的非金属作正极,得电子的化合价降低的可溶性反应物作电解质溶液,据此设计原电池;(2)原电池中,易失电子的电极铜为负极,银作正极,正极上得电子发生还原反应;(3)电子从负极沿导线流向正极.

【题目】金属钛因为其优越的性能被称为“未来金属”,其工业冶炼涉及到的反应如下:TiO2+2C+2Cl2![]() TiCl4+2CO
TiCl4+2CO
回答下列相关问题:
(1)钛的价层电子排布式为______________。
(2)已知部分物质熔沸点如下:
名称 | 金红石 | 金刚石 | 四氯化钛 | 四溴化钛 | 四碘化钛 |
化学式 | TiO2 | C | TiCl4 | TiBr4 | TiI4 |
熔点 | 1830℃ | 3550℃ | -24.1℃ | 38℃ | 150℃ |
沸点 | 2927℃ | 4827℃ | 136.4℃ | 233.1℃ | 377.2℃ |
晶型 | 离子晶体 | 分子晶体 | |||
表中金刚石的晶型为_________;自左向右,表中的三种钛的卤化物熔沸点依次升高的原因是_____________。
(3)配位数为6,组成为TiCl3·6H2O的晶体有两种:化学式为[TiCl(H2O)5]Cl2·H2O的X呈绿色,定量实验表明,X与AgNO3以1:2物质的量比反应生成沉淀。Y呈紫色,且Y与AgNO3以1:3物质的量比反应生成沉淀,则Y的化学式为___________,Y配离子的空间构型为_________。
(4)钙钛矿是重要的含钛矿物之一,其主要成分Z的晶胞如下图所示:
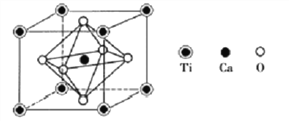
推测Z的化学式为________________。
(5)若晶胞参数a=384.1pm,Z晶体的密度为______g/cm3(已知NA≈6.0×1023;3.8413≈![]() )。
)。