题目内容
【题目】碳是形成单质和化合物最多的元素,其单质及化合物有独特的性质和用途。请回答下列问题。
(1)C原子的价电子轨道表达式为______________________。
(2)碳元素是组成有机物必不可少的元素。1828年,化学家维勒首次用加热的方法将无机物氰酸铵[NH4(OCN)]转化为有机物尿素,开启了人造有机物的大门。氰酸铵中阳离子的立体构型是___________。有机物M(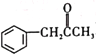 )在一定条件下生成N(
)在一定条件下生成N(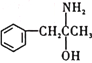 )
)
①沸点:M___________N(填“大于”或“小于”)。
②M中碳原子的杂化类型为___________,不同杂化类型的碳原子数之比为___________。
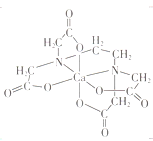
(3)碳的有机物常作为金属有机化合物的配体,如EDTA(乙二胺四乙酸)。EDTA与Ca2+形成的配离子如图所示。该配离子的配位数是___________,配体中碳原子的杂化方式有_________。
(4)石墨晶体由层状石墨“分子”按ABAB方式堆积而成,如图所示,图中用实线标出了石墨的一个六方晶胞。
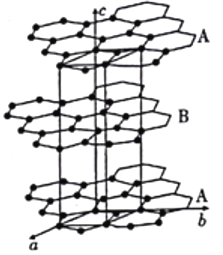
①石墨中C原子上未参与杂化的所有p轨道相互平行且重叠,使p轨道中的电子可在整个碳原子平面中运动而导电。六方氮化硼(BN)与石墨晶体结构类似,硼原子和氮原子交替相连,而六方BN却无法导电,其原因是___________。
②晶胞有两个基本要素:石墨一种晶胞结构和部分晶胞参数如图。
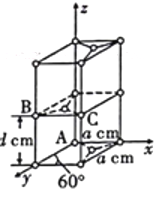
a.原子坐标参数描述的是晶胞内原子间的相对位置。石墨晶胞中碳原子A、B的坐标参数分别为A(0,0,0)、B(0,1,![]() ),则C原子的坐标参数为___________。
),则C原子的坐标参数为___________。
b. 晶胞参数用以描述晶胞的大小和形状。已知石墨晶胞底边长为acm,层间距为 d cm,阿伏加德罗常数的值为NA,则石墨的密度为___________g·cm-3(写出表达式即可)
【答案】![]() 正四面体 小于 sp2、sp3杂化 7︰2 6 sp2和sp3杂化 氮的电负性较大,相互平行且重叠p轨道(或大兀键)上的电子在很大程度上被定域在氮的周围,不能自由流动
正四面体 小于 sp2、sp3杂化 7︰2 6 sp2和sp3杂化 氮的电负性较大,相互平行且重叠p轨道(或大兀键)上的电子在很大程度上被定域在氮的周围,不能自由流动 ![]()
![]()
【解析】
(1)碳原子价电子排布式为2s22p2;
(2) 氰酸铵中阳离子为NH4+离子;
①对结构相似的有机物,其分子量越大沸点就越高;
②M中含有C-C、苯环以及C=O;
(3)由图可知,EDTA与Ca2+形成的配离子中为Ca2+中心离子,EDTA中N、O原子与Ca2+之间形成配位键;EDTA中含有饱和碳原子和—COO—;
(4)①由于N和B的电负性相差较大;
②a.由B点坐标可得,a=1,d=1/2,所以C点坐标为(1,1,1/2);
b. 由石墨的晶胞结构得晶胞中C原子的数量为1+2×1/2+8×1/8+4×1/4=4,晶胞体积为2d×a×a×sin60°=![]() 。
。
(1)碳原子价电子排布式为2s22p2,根据能量最低原理、泡利不相容原理和洪特规则,其价电子原子轨道表示式为![]() ,故答案为:
,故答案为:![]() ;
;
(2) 氰酸铵中阳离子为NH4+离子,NH4+离子中N原子价层电子对数为4,孤对电子数为0,故空间构型为正四面体形,故答案为:正四面体;
①对结构相似的有机物,其分子量越大沸点就越高,所以沸点M小于N,故答案为:小于;
②因为M中含有C-C、苯环以及—COO—,所以M中C原子的杂化方式为sp2、sp3杂化,两种杂化方式的碳原子比例为:(6+1):2=7:2,故答案为:sp2和sp3杂化;7:2;
(3)由图可知,EDTA与Ca2+形成的配离子中为Ca2+中心离子,EDTA中N、O原子与Ca2+之间形成配位键,Ca2+的配位数为6;EDTA中含有饱和碳原子和—COO—,故C原子的杂化方式为sp2、sp3杂化,故答案为:6;sp2和sp3杂化;
(4)①由于N和B的电负性相差较大,在六方氮化硼晶体中相互平行且重叠p轨道(或大兀键)上的电子在很大程度上被定域在N原子的周围,不能自由流动,故不能导电,故答案为:氮的电负性较大,相互平行且重叠p轨道(或大兀键)上的电子在很大程度上被定域在氮的周围,不能自由流动;
②a.由B点坐标可得,a=1,d=1/2,所以C点坐标为(1,1,1/2),故答案为:(1,1,1/2);
b. 由石墨的晶胞结构得晶胞中C原子的数量为1+2×1/2+8×1/8+4×1/4=4,晶胞体积为2d×a×a×sin60°=![]() ,则石墨的密度为
,则石墨的密度为![]() ,故答案为:
,故答案为:![]() 。
。

【题目】I.实验室用50 mL 0.50mol/L盐酸、50mL 0.55 mol/LNaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:

实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |
完成下列问题:
(1)图中实验装置中尚缺少的玻璃仪器是____________________________.
(2)在操作正确的前提下,提高中和热测定准确性的关键是________________________.
(3)根据上表中所测数据进行计算,则该实验测得的中和热△H=_________[盐酸和NaOH溶液的密度按1g/cm3计算,反应后混合溶液的比热容(c)按4.18J/(g·℃)计算].
(4)如用0.5 mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将_____(填“偏大”、“偏小”、“不变”).如改用60 mL0.5moI/L的盐酸与50 mL 0.55mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量______(填“相等”或“不相等”),所求中和热_____(填“相等”或“不相等”)。
(5) 上述实验结果数值与57.3相比有偏差,产生偏差的原因可能是(填字母)______.
A.测量盐酸的温度后,温度计没有用水冲洗干净
B. 把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.在量取NaOH溶液时仰视计数
E.大烧杯的盖扳中间小孔太大。
Ⅱ.某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过褪色所需时间来判断反应的快慢。该小组设计了如下方案:
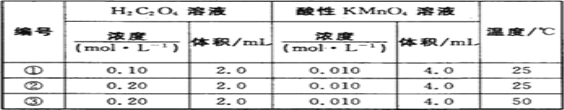
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4):n(KMnO4) ≥_______。
(2)试验编号②和③探究的内容是_____________。
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=__________mol·L-1·min-1。