题目内容
11.标准状况下,CO2和N2的混合气体的质量是9.6g,体积是6.72L,则CO2在混合物中的质量分数约为( )| A. | 25% | B. | 35% | C. | 75% | D. | 50% |
分析 标准状况下,Vm=22.4L/mol,n(混合气体)=$\frac{6.72L}{22.4L/mol}$=0.3mol,结合质量、物质的量关系计算.
解答 解:标准状况下,Vm=22.4L/mol,n(混合气体)=$\frac{6.72L}{22.4L/mol}$=0.3mol,
设CO2和N2的物质的量分别为x、y,则
$\left\{\begin{array}{l}{44x+28y=9.6}\\{x+y=0.3}\end{array}\right.$,
解得x=0.075mol,
则CO2在混合物中的质量分数为$\frac{0.075mol×44g/mol}{9.6g}$≈35%,
故选B.
点评 本题考查物质的量的计算,为高频考点,把握物质的量的相关计算公式为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
4. 醇脱水是合成烯烃的常用方法,实验室合成环已烯的反应和实验装置(夹持装置已略去)如下可能用到的有关数据如下:
醇脱水是合成烯烃的常用方法,实验室合成环已烯的反应和实验装置(夹持装置已略去)如下可能用到的有关数据如下:
合成反应: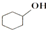 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +H2O,在a中加入20g环已醇和2小片碎片,冷却搅动下慢慢加入1mL浓硫酸.B中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.
+H2O,在a中加入20g环已醇和2小片碎片,冷却搅动下慢慢加入1mL浓硫酸.B中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环已烯10g.
回答下列问题:
(1)装置b的名称是冷凝管.
(2)加入碎瓷片的作用是防止暴沸;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B(填正确答案称号).
A.立即补加B.冷却后补加C.不需补加D.重新配料
(3)分液漏斗在使用前须清洗干净并检漏;在本实验分离过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”或“下口放出”).
(4)分离提纯过程中加入无水氯化钙的目的是干燥.
 醇脱水是合成烯烃的常用方法,实验室合成环已烯的反应和实验装置(夹持装置已略去)如下可能用到的有关数据如下:
醇脱水是合成烯烃的常用方法,实验室合成环已烯的反应和实验装置(夹持装置已略去)如下可能用到的有关数据如下:| 相对分子质量 | 密度(g•cm-3) | 沸点(℃) | 溶解性 | |
| 环已醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环已烯 | 82 | 0.8102 | 83 | 难溶于水 |
 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +H2O,在a中加入20g环已醇和2小片碎片,冷却搅动下慢慢加入1mL浓硫酸.B中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.
+H2O,在a中加入20g环已醇和2小片碎片,冷却搅动下慢慢加入1mL浓硫酸.B中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环已烯10g.
回答下列问题:
(1)装置b的名称是冷凝管.
(2)加入碎瓷片的作用是防止暴沸;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B(填正确答案称号).
A.立即补加B.冷却后补加C.不需补加D.重新配料
(3)分液漏斗在使用前须清洗干净并检漏;在本实验分离过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”或“下口放出”).
(4)分离提纯过程中加入无水氯化钙的目的是干燥.
2.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 常温常压下64g SO2含有氧原子数为1NA | |
| B. | 物质的量浓度为0.5mol•L-1的MgCl2溶液,含有Cl-数为1NA | |
| C. | 标准状况下,11.2LSO3含有的原子数目为2NA | |
| D. | 任何条件下,0.5mol N2含有分子数一定是0.5NA |
6.下列电离方程式错误的是( )
| A. | KNO3═K++NO3- | B. | NaHSO4═Na++H++SO42- | ||
| C. | BaCl2═Ba2++Cl2- | D. | Na2SO4═2Na++SO42- |
16.下列说法不正确的是( )
| A. | 金属单质和盐溶液的反应不一定是置换反应 | |
| B. | “水滴石穿”是因为CaCO3与CO2、水发生了化学反应 | |
| C. | 纯碱是制作面包等糕点的膨松剂,也是治疗胃酸过多的一种药剂 | |
| D. | 少量液溴可用水封存,防止溴挥发 |
3.根据表中信息,判断下列叙述中正确的是( )
| 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 | |
| ① | Cl2 | FeBr2 | Cl- | ||
| ② | KClO | 浓盐酸 | Cl2 | ||
| ③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
| A. | 第①组的反应,当Cl2与FeBr2物质的量之比≤1:2时,只有一种元素被氧化 | |
| B. | 第②组事实可以推测:ClO-、Cl-不能在溶液中大量共存 | |
| C. | 氧化性强弱的比较:KClO<Cl2 | |
| D. | 第③组反应的离子方程式为:2MnO4-+3H2O2+6H+═2Mn2++4O2↑+6H2O |
20.向氯化亚铁溶液中滴入氢氧化钠溶液后,沉淀颜色变化顺序为( )
| A. | 红褐色、灰绿色、白色 | B. | 白色、红褐色、黑色 | ||
| C. | 白色、灰绿色、红褐色 | D. | 蓝色、灰绿色、绿色 |