题目内容
常温下,将0.1 mol·L-1氢氧化钠溶液与0.06 mol·L-1硫酸溶液等体积混合,该混合溶液的pH等于( )
| A.1.7 | B.2.0 | C.12.0 | D.12.4 |
B
解析

练习册系列答案
相关题目
25oC时,取浓度均为0.1 mol·L-1的醋酸溶液和氨水溶液各20 mL,分别用0.1 mol·L-1NaOH溶液、0.1 mol·L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示。下列说法正确的是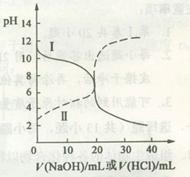
| A.曲线I中滴加溶液到10 mL时:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| B.曲线I中滴加溶液到25 mL时:c(NH4+)>c(C1-)>c(H+)>c(OH-) |
| C.曲线II中滴加溶液在10 mL~25 mL之间存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+) |
| D.曲线II中滴加溶液到10mL时:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
下列叙述或表示正确的是
| A.0.1 mol·L-1的醋酸的pH=a,0.01 mol·L-1的醋酸的pH=b,则a+1=b |
| B.常温下0.1 mol·L-1的醋酸溶液与等浓度等体积NaOH溶液反应后的溶液中:c(CH3COOH)+c(CH3COOˉ)="0.1" mol·L-1 |
| C.难溶电解质AB2的饱和溶液中,c(A2+)=xmol·L-1, c(B-)="y" mol·L-1,则Ksp值为4xy2 |
| D.用200mL4 mol·L-1的NaOH溶液将0.6mol CO2完全吸收,反应的离子方程式为:3CO2+4OHˉ=CO32ˉ+2HCO3ˉ+H2O |
已知酸H2B在水溶液中存在下列关系:①H2B H++HB- ②HB-
H++HB- ②HB- H++B2-,关于该酸对应的酸式盐NaHB的溶液,下列说法中一定正确的是( )
H++B2-,关于该酸对应的酸式盐NaHB的溶液,下列说法中一定正确的是( )
| A.NaHB属于弱电解质 |
| B.溶液中的离子浓度[Na+]>[HB-]>[H+]>[OH-] |
| C.[Na+]=[HB-]+[B2-]+[H2B] |
| D.NaHB和NaOH溶液反应的离子方程式为H++OH-=H2O |
已知25 ℃时,AgCl的溶度积Ksp=1.8×10-10,则下列说法正确的是( )
| A.向饱和AgCl水溶液中加入盐酸,Ksp变大 |
| B.AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-) |
| C.温度一定时,当溶液中c(Ag+)·c(Cl-)=Ksp时,此溶液中必有AgCl的沉淀析出 |
| D.将AgCl加入到较浓的KI溶液中,部分AgCl转化为AgI,因为AgCl的溶解度大于AgI的 |
用NaOH滴定pH相同、体积相同的H2SO4、HCl、CH3COOH三种溶液,恰好中和时,所用相同浓度NaOH溶液的体积依次为V1、V2、V3,则这三者的关系是( )
| A.V1>V2>V3 | B.V1<V2<V3 |
| C.V1=V2>V3 | D.V1=V2<V3 |
将AgCl分别加入盛有:①5 mL水;②6 mL 0.5 mol/L NaCl溶液;③10 mL 0.2 mol/L CaCl2溶液;④50 mL 0.1 mol/L盐酸的烧杯中,均有固体剩余,各溶液中c(Ag+)从大到小的顺序排列正确的是( )
| A.④③②① | B.②③④① | C.①④③② | D.①③②④ |
下列各溶液中,pH最大的是( )
| A.pH=9的氨水稀释1 000倍 |
| B.pH=9的烧碱溶液稀释1 000倍 |
| C.pH=5的盐酸稀释1 000倍 |
| D.pH=5的氯化铵溶液稀释1 000倍 |
在25 ℃时,将0.2 mol CH3COONa晶体和0.1 mol HCl气体同时溶解于同一烧杯的水中,制得1 L溶液,若此溶液中c(CH3COO-)>c(Cl-),则下列判断不正确的是( )
| A.该溶液的pH小于7 |
| B.c(CH3COOH)+c(CH3COO-)=0.20 mol·L-1 |
| C.c(CH3COOH)<c(CH3COO-) |
| D.c(CH3COO-)+c(OH-)=0.10 mol·L-1 |