��Ŀ����
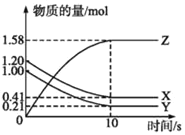
����Ŀ��I.һ���¶��£���2L���ܱ������У�X��Y��Z������������ʵ�����ʱ��仯��������ͼ��ʾ��
(1)д���÷�Ӧ�Ļ�ѧ����ʽ___________________
(2)���������в���˵��������Ӧ�ﵽƽ��״̬����___________��
A����X��Y�ķ�Ӧ����֮��Ϊ1��1
B���ڻ��������X�������ٷ������ֲ���
C����������ƽ��Ħ����������ʱ��ı仯���仯
D�����������ܶȲ���ʱ��ı仯���仯
E��X��Y��Z��Ũ��֮��Ϊ1��1��2
(3)Ϊʹ�÷�Ӧ�ķ�Ӧ���ʼ�С���ɲ�ȡ�Ĵ�ʩ��_____��
A ��ѹʱ����Ne���� ��B �ʵ������¶�
C ��С��������� D ѡ���Ч������
II.һ���¶��½�3mol��A��3molB�����2L���ܱ�
�����У��������·�Ӧ��3A(g)+B(g)![]() xC(g)+2D(g)������5������Ӧ�ﵽƽ�⣬���A��ת����Ϊ60����C��ƽ����Ӧ������0.18mol/(L.min)��
xC(g)+2D(g)������5������Ӧ�ﵽƽ�⣬���A��ת����Ϊ60����C��ƽ����Ӧ������0.18mol/(L.min)��
��(1)ƽ��ʱB��Ũ��=______mol/L��
(2)D��ƽ����Ӧ���ʦ�(D)=______mol/( L.min)��
(3)x=______��
���𰸡�X(g)+Y(g)![]() 2Z(g) ACDE A 1.2 0.12 3
2Z(g) ACDE A 1.2 0.12 3
��������
I.(1)���ݻ�ѧ��Ӧ�и����ʵ����ʵ����ı仯���뻯ѧ������֮�ȳ�������д��ѧ����ʽ��
(2)���ݿ��淴Ӧƽ��״̬ʱ��ʵ�ʺ���������Ϸ�Ӧ����ʽ�����ʵĻ�ѧ��������ϵ�ж�ƽ��״̬��
(3)����Ӱ�컯ѧ��Ӧ���ʵ����ط����жϣ�
II.����A��ʼʱ�����ʵ�����ת���ʼ���ת�������������ʶ���ʽ����V(A)��Ȼ��������ʱȵ��ڻ�ѧ�������ıȣ����V(C)��С������V(B)��V(D)��xֵ��
(1)��ͼ����Կ���X��Y�����ʵ�����С��Z�����ʵ������࣬��X��YΪ��Ӧ�ZΪ�������ѧ��Ӧ�и����ʵ����ʵ����仯���뻯ѧ������֮�ȳ����ȣ�����Y��X��Z=(1.20mol-0.41mol)��(.0mol-0.21mol)��1.58mol=1��1��2����������������ʶ����ڣ��ɼ��÷�ӦΪ���淴Ӧ����Ӧ�Ļ�ѧ����ʽΪX+Y![]() 2Z��
2Z��
(1) A.X��Y�Ƿ�Ӧ�����ʽ��ϵ����ͬ�����κ�����¶��߷�Ӧ���ʶ���ȣ���˲��ܸ���X��Y�ķ�Ӧ����֮��Ϊ1��1�ж�ƽ��״̬��A�������⣻
B.����Ӧ�ﵽƽ��״̬���κ�һ��ֵ��������䣬�����ʵ������������䣬���ڻ��������X�������ٷ������ֲ�������жϷ�Ӧ����ƽ��״̬��B���������⣻
C.���ڷ�Ӧǰ��������������䣬��������ʵ������䣬���Ի�������ƽ��Ħ���������Dz���ʱ��ı仯���仯���ʲ��ܾݴ��ж�ƽ��״̬��C�������⣻
D.���ڷ�Ӧǰ��������������䣬�����������䣬���Ի��������������ܶ����Dz���ʱ��ı仯���仯���ʲ��ܾݴ��ж�ƽ��״̬��D�������⣻
E.X��Y��Z��Ũ��֮��Ϊ1��1��2���ܴ���ƽ��״̬��Ҳ���ܲ���ƽ��״̬��E�������⣻
�ʺ���ѡ����ACDE��
(3) A.��ѹʱ����Ne���������ݻ��������ʵ�Ũ�ȼ�С����Ӧ���ʼ�С��A�������⣻���� ��B.�ʵ������¶ȣ����ʵ��������ӣ���Ӧ���ʼӿ죬B���������⣻
C.��С��������������ʵ�Ũ������ѧ��Ӧ���ʼӿ죬C���������⣻
D.ѡ���Ч��������ѧ��Ӧ���ʼӿ죬D���������⣻
�ʺ���ѡ����A��
II.������Ӧ3A(g)+B(g)![]() xC(g)+2D(g)�����ڷ�Ӧ��2L���ܱ������ڽ��У�n(A)= 3mol��A��ת������60%����Aת����Ϊ��n=3mol��60%=1.8mol��
xC(g)+2D(g)�����ڷ�Ӧ��2L���ܱ������ڽ��У�n(A)= 3mol��A��ת������60%����Aת����Ϊ��n=3mol��60%=1.8mol��
(1)���ݷ�Ӧ����ʽ��ϵ����֪��ÿ��3molA������Ӧ��ͬʱ����1molB����A��Ӧ��1.8mol������B��Ӧ��0.6mol����5minʱB���ʵ�Ũ��Ϊc(B)=(3mol-0.6mol)��2L=1.2mol/L��
(2) Aת����Ϊ��n=3mol��60%=1.8mol���������ݻ�Ϊ2L����Ӧʱ��Ϊ5min������V(A)=![]() =0.18mol/(L��min)������V(A)��V(D)=3:2������V(D)=
=0.18mol/(L��min)������V(A)��V(D)=3:2������V(D)=![]() V(A)= 0.12 mol/(L��min)��
V(A)= 0.12 mol/(L��min)��
(3)V(A):V(C)=3:x��V(A)=V(C)=0.18mol/(L��min)������x=3��

����Ŀ������ͼ��ʾװ�ý�������ʵ�飬ʵ������Ԥ�������һ�µ���

���е����� | ���е����� | Ԥ���������� | |
A | ���۵⻯����Һ | Ũ���� | ���������� |
B | ��̪��Һ | Ũ���� | ���������� |
C | �Ȼ�����Һ | Ũ��ˮ | �а�ɫ���� |
D | ʪ���ֽ�� | ������ˮ | ��ֽ����ɫ |
A. A B. B C. C D. D
����Ŀ������10��Ԫ�ص����ʡ��������±����У����Ǿ�Ϊ������Ԫ�أ�
A | B | C | D | E | F | G | H | I | J | |
ԭ�Ӱ뾶(10��10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | 1.02 | 0.037 |
�����ͻ��ϼ� | +2 | +1 | +5 | +7 | +1 | +5 | +3 | +6 | +1 | |
��2 | ��3 | ��1 | ��3 | ��2 |
�ش��������⣺
(1)G��Ԫ�����ڱ��е�λ��_____����H��һ��ͬλ��������Ϊ5������ԭ�ӷ�����_____��B Ԫ�ص����ӽṹʾ��ͼ��_____��A��B�ֱ��γɵļ����Ӱ뾶��С��ϵΪ_____(�����ӷ��ű�ʾ)��
(2)������F2A2�ĵ���ʽ�ǣ�________________________��
(3)�õ���ʽ��ʾF2I���γɹ��̣�_________________________��
(4)F��J�γɵĻ�������ˮ��Ӧ�ų�����Ļ�ѧ����ʽΪ_____��