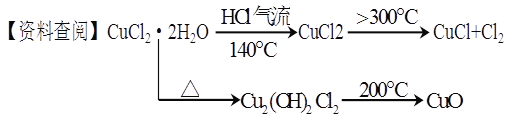题目内容
【题目】在水溶液中,YO3-与S2-发生反应的离子方程式为:YO3-+3S2-+6H+=Y-+3S↓+3H2O。请回答:
(1)此反应中,_______发生氧化反应,氧化剂是_______。
(2)YO3-中Y的化合价是_______。
(3)Y元素原子的最外层电子数是_______,它可能处于第_______族。
【答案】
【解析】
(1)YO3-+3S2-+6H+=Y-+3S↓+3H2O,该反应中,化合价变化为:S2-→S,S元素的化合价由-2价→0价,失电子作还原剂,还原剂被氧化,氢元素的化合价没有变化,所以YO3-作氧化剂,
故答案为:S2-;YO3-。
(2)由YO3-符号可知酸根阴离子的化合价为-1价,氧元素为-2价,设Y元素化合价为x,则Y+(-2)×3=-1,Y=+5,故答案为:+5。
(3)由Y-可知,Y的最低负化合价为-1价,因最高正化合价+|最低负化合价|=8,所以最高正化合价为+7价,因最外层电子数=最高正化合价=主族序数,所以最外层电子数为7,处于第ⅦA族,故答案为:7;第ⅦA族。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目