题目内容
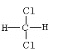
【题目】有机物的结构可用“键线式”表示,如CH3—CH=CH—CH3可简写为![]() ,有机物X的键线式为
,有机物X的键线式为![]() 。下列关于有机物X的说法中正确的是
。下列关于有机物X的说法中正确的是
A. X的含氧官能团是羧基和醚键
B. X的分子式为C7H7O3
C. X因能与酸性KMnO4溶液发生取代反应而褪色
D. 有机物Y是X的同分异构体,能与碳酸氢钠溶液反应且含苯环,则Y的结构有3种
【答案】D
【解析】
A.有机物含有碳碳双键、羰基、羟基和醚键,而乙酸乙酯只含酯基,故A错误;B.由结构简式可以知道有机物分子式为C7H6O3,故B错误; C.X含有碳碳双键,可与高锰酸钾发生氧化还原反应,故C错误;D.有机物分子式为C7H6O3,有机物Y是X的同分异构体,能与碳酸氢钠溶液反应且含有苯环,则分子中含有羟基、羧基,有邻、间、对3种同分异构体,故D正确;答案:D。

【题目】实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)K2FeO4作为高效、多功能水处理剂的原因是______________________________。
(2)制备K2FeO4(夹持装置略)

①A为氯气发生装置。A中反应方程式是_____________________________。
②该装置有明显不合理设计,如何改进?____________________________。
③改进后,B中得到紫色固体和溶液。B中Cl2发生的反应有3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O,另外还有____________________________。
(3)探究K2FeO4的性质(改进后的实验)
①取B中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
方案Ⅱ | 用KOH溶液充分洗涤B中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
a.由方案Ⅰ中溶液变红可知a中含有______离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由_________________________产生(用方程式表示)。
b.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是______________。
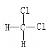
②根据K2FeO4的制备实验和方案Ⅱ实验表明Cl2和![]() 的氧化性强弱关系相反,原因是_____________。
的氧化性强弱关系相反,原因是_____________。