题目内容
(2012?唐山二模)将两根Pt丝作电极插入KOH溶液中,然后向两极上分别通入甲烷和氧气而构成燃料电池,该电池中反应的化学方程式:CH4+2O2+2KOH═K2CO3+3H2O,则关于此燃料电池的下列说法正确的是( )
分析:甲烷碱性燃料电池工作时,正极发生还原反应,电极反应式为O2+4e-+2H2O═4OH-,甲烷在负极发生氧化反应,电极反应式为CH4+10OH--8e-═CO32-+7H2O,根据电极方程式以及题目要求分析解答.
解答:解:A.放电时,甲烷失电子发生氧化反应,所以通入甲烷的电极为负极,故A错误;
B.温度和压强未知,无法计算甲烷的物质的量,导致无法计算转移电子数,故B错误;
C.根据电池反应式知,氢氧化钾在反应中作反应物,所以放电过程中,氢氧根离子浓度减小,溶液的pH减小,故C错误;
D.放电时,甲烷失电子发生氧化反应,电极反应式为CH4+10OH--8e-═CO32-+7H2O,故D正确;
故选D.
B.温度和压强未知,无法计算甲烷的物质的量,导致无法计算转移电子数,故B错误;
C.根据电池反应式知,氢氧化钾在反应中作反应物,所以放电过程中,氢氧根离子浓度减小,溶液的pH减小,故C错误;
D.放电时,甲烷失电子发生氧化反应,电极反应式为CH4+10OH--8e-═CO32-+7H2O,故D正确;
故选D.
点评:本题考查了燃料电池知识,燃料电池电极反应式的书写要注意结合电解质溶液书写,易错选项是B,很多同学往往漏掉气体摩尔体积的适用条件而导致错误,为易错点.

练习册系列答案
相关题目
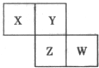 (2012?唐山二模)X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示,若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
(2012?唐山二模)X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示,若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )