题目内容
17. 有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2.则:
有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2.则:(1)D的元素符号为Ca.
(2)B元素的氢化物的沸点是同族元素氢化物中最高的,原因是水分子间之间存在氢键,氢键比范德华力更强
(3)A、B、C 3种元素的第一电离能由大到小的顺序为F>N>O(用元素符号表示).
(4)写出基态E原子的价电子排布式:3d104s1.
(5)A的最简单氢化物分子的空间构型为三角锥形,其中A原子的杂化类型是sp3.
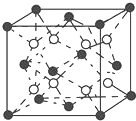
(6)C和D形成的化合物的晶胞结构如图所示,已知晶体的密度为ρ g•cm-3,阿伏加德罗常数为NA,求晶胞边长a=$\root{3}{\frac{312}{ρ•{N}_{A}}}$cm.(用ρ、NA的计算式表示)
分析 有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30),A的基态原子2p能级有3个单电子,原子核外电子排布为1s22s22p3,则A是N元素;C的基态原子2p能级有1个单电子,且C的原子序数大于A,其原子核外电子排布为1s22s22p5,所以C是F元素,结合原子序数可推知B是O元素;E原子核外有成单电子,其次外层有3个能级且均排满电子,且原子序数小于30,则E处于第四周期,其基态原子的价电子排布式[Ar]3d104s1,则E是Cu元素;D与E同周期,价电子数为2,则D是Ca元素,据此解答.
解答 解:有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30),A的基态原子2p能级有3个单电子,原子核外电子排布为1s22s22p3,则A是N元素;C的基态原子2p能级有1个单电子,且C的原子序数大于A,其原子核外电子排布为1s22s22p5,所以C是F元素,结合原子序数可推知B是O元素;E原子核外有成单电子,其次外层有3个能级且均排满电子,且原子序数小于30,则E处于第四周期,其基态原子的价电子排布式[Ar]3d104s1,则E是Cu元素;D与E同周期,价电子数为2,则D是Ca元素,
(1)根据上面的分析可知,D是Ca元素,故答案为:Ca;
(2)水分子间能存在氢键,氢键比范德华力更强,H2O的沸点是同族元素中最高的,
故答案为:水分子间之间存在氢键,氢键比范德华力更强;
(3)同一周期中,元素的第一电离能随着原子序数的增大呈增大趋势,但N元素2p能级容纳3个电子,处于半满稳定状态,能量较低,第一电离能大于同周期相邻元素,素第一电离能由大到小的顺序为F>N>O,
故答案为:F>N>O;
(4)E是铜元素,根据构造原理知,其基态原子的价电子排布式[Ar]3d104s1,故基态Cu原子的价电子排布式为:3d104s1,
故答案为:3d104s1;
(5)N元素的简单氢化物是氨气,NH3分子中氮原子价层电子对=3+$\frac{5-1×3}{2}$=4,且含有一个孤电子对,所以分子空间构型是三角锥形,N原子采取sp3杂化,
故答案为:三角锥形;sp3;
(6)F和Ca形成的化合物为CaF2,由晶胞结构可知,晶胞中白色球数目=8、黑色球数目=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,白色球为F、黑色球为Ca,则晶胞质量=4×$\frac{78g}{{N}_{A}}$=$\frac{312}{{N}_{A}}$g,晶胞的体积=$\frac{\frac{312}{{N}_{A}}}{ρ}$cm3=$\frac{312}{ρ•{N}_{A}}$cm3,故晶胞边长a=$\root{3}{\frac{312}{ρ•{N}_{A}}}$cm,
故答案为:$\root{3}{\frac{312}{ρ•{N}_{A}}}$.
点评 本题考查物质结构与性质,涉及核外电子排布、分子空间构型、化学键、杂化方式、电离能、晶胞计算等,都是考试热点,注意第一电离能的变化趋势及异常现象,为易错点.

 阅读快车系列答案
阅读快车系列答案| A. | CH3Cl | B. | C4H10 | C. | C2H4Cl2 | D. | C |
| A. | 标准状况下,3.36 L NO2与水充分反应转移的电子数为0.1NA | |
| B. | 12 g金刚石中含有的共价键数为4NA | |
| C. | 将22.4 L Cl2通入足量水中,反应转移的电子数为NA | |
| D. | 1 L 1 mol•L-1的NaClO溶液中含有ClO-的数目为NA |
| A. | AgNO3和HBr | B. | Ca(HCO3)2和HNO3 | C. | Ba(NO3)2和CO2 | D. | NaHCO3和Ca(OH)2 |
| A. | 离子化合物中不可能含有共价键 | |
| B. | 晶体中一定存在化学键 | |
| C. | 碱性氧化物一定是金属氧化物 | |
| D. | 直径介于1-10nm之间的微粒称为胶体 |
| A. | 在乙醇分子间,既存在分子间作用力又存在氢键 | |
| B. | 带相反电荷离子之间的相互吸引称为离子键 | |
| C. | 同素异形体间的相互转化属于物理变化 | |
| D. | H2O比H2S稳定,因为水分子间有氢键 |
| A. | 人体运动所消耗的能量与化学反应有关 | |
| B. | 煤和石油都属于化石燃料 | |
| C. | 化学反应必然伴随发生能量变化 | |
| D. | 不需要加热就能进行的反应都是放热反应 |
 一无色透明的溶液做如下实验:
一无色透明的溶液做如下实验: