��Ŀ����
����Ŀ��ijͬѧ������ʵ��װ�����ʵ���Ʊ�SO2�����������̽�����
����֪������ǿ��ΪH2SO3��H2CO3��HClO��
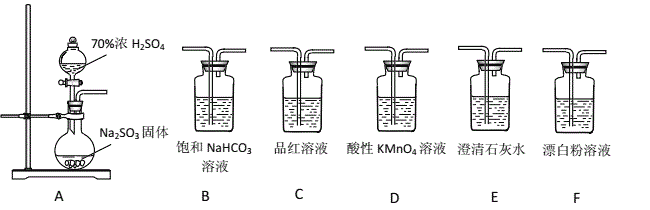
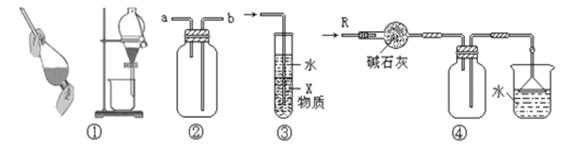
��1��װ��A�з�Ӧ�Ļ�ѧ����ʽΪ_________________________________________��
��2����ͬѧ������װ����ѡ����ʵ�װ����֤��������̼�������ǿ���������õ���C��Dװ�á�
��Cװ�õ�������___________________________��
��ͨ��___________________________________________________����ʵ��������֤������������ǿ��̼�ᡣ
��3����ͬѧ��Ϊ��������װ��Ҳ����֤�������������ǿ�ڴ����ᣬ��д����ȷ��װ������˳��A��( )��( ) �� C �� F ��____________
��4����ͬѧ��A�в�����������SO2ͨ����ͼװ��G�У�G���а�ɫ�������ɡ��ó����Ļ�ѧʽΪ_________��
I���Ʋ����������ԭ�������(�����ǿ�����Ӱ��)
ԭ��һ��SO2�����������±�NO3��������
ԭ�����SO2��Fe3+������
ԭ������_____________________________________________��
II�������ͬѧ��Ϊ����Ϊ��ԭ����������˰�ɫ������
������д��SO2��Fe3+���������ӷ���ʽ��_________________________________
�ڼ���Fe3+ǡ����ȫ��Ӧ���������ʵ��֤���仹ԭ�������Ҫ����ʵ����̡������ۡ�
___________________________________
���𰸡� Na2SO3+H2SO4(Ũ)=Na2SO4+SO2��+H2O ����SO2�Ƿ���� C��Ʒ����Һ����ɫ��E��ʯ��ˮ����� A����B������D����C��F BaSO4 SO2��Fe3+�����������µ�NO3���������˷�Ӧ SO2 +2Fe3+ + 2H2O = SO42��+2Fe2++ 4H+ ȡ������Ӧ����ϲ���Һ���Թ��У��μӼ���K3[Fe(CN)6]��Һ������ɫ�������ɣ�˵����Ӧ����Fe2+���ɣ������KSCN�������ټ�����ˮ��Һ��Ѫ��ɫ����Fe2+����Ҳ������������֤����Ӧ����Һ����Fe2+������������
����������1��Ũ�������������Ʒ�Ӧ���������ơ�����������ˮ����ѧ����ʽΪ��Na2SO3+H2SO4(Ũ)=Na2SO4+SO2��+H2O ����ȷ���� Na2SO3+H2SO4(Ũ)=Na2SO4+SO2��+H2O��
��2���ٶ�������Ͷ�����̼���������ʯ��ˮ��Ӧ���ɰ�ɫ������Ϊ����֤����������ǿ��̼�ᣬֻ��֤���ж�����̼���ɼ��ɣ���Ҫ��ȥ��������Cװ�þ���Ϊ�˼���SO2�Ƿ��������C��Ʒ����Һ����ɫ��E��ʯ��ˮ����ǣ�˵���ж�����̼���ɣ�������������ǿ��̼���ȷ��������SO2�Ƿ���� ��
��C��Ʒ����Һ����ɫ��˵�����������Ѿ�������E��ʯ��ˮ����� ��˵���ж�����̼�����������ȷ���� C��Ʒ����Һ����ɫ��E��ʯ��ˮ�����
��3��������Aװ�ò�����������ͨ��Bװ����̼�����Ʋ���������̼������Dװ�������Ը�����س�ȥ����������Cװ�ü�����������Ƿ���������ͨ��Fװ�ã���Fװ���г��ְ�ɫ��������˵��̼������ǿ�ڴ����ᣬ��ϣ�2������֤������������ǿ�ڴ����ᣬ��װ������˳��ΪA��B��D��C��F����ȷ����A����B������D����C��F��
(4)����������л�ԭ�����������������ܹ�����������ӻ�����������Ϊ���������������������뱵���ӷ�Ӧ�������ᱵ��ɫ���������Գ���ΪBaSO4 ����ȷ����BaSO4��
I��SO2�����������±�NO3��������SO2��Fe3+�����������������£�SO2��Fe3+��NO3����������ȷ�𰸣�SO2��Fe3+�����������µ�NO3���������˷�Ӧ ��
II����SO2��Fe3+����Ϊ��������ӣ������ӱ���ԭΪ�������ӣ����ӷ���ʽ��SO2 +2Fe3+ + 2H2O = SO42��+2Fe2++ 4H+ ����ȷ����SO2 +2Fe3+ + 2H2O = SO42��+2Fe2++ 4H+ ��
�ڼ���Fe3+ǡ����ȫ��Ӧ����Һ�к����������ӣ��������ӵļ��鷽�����ȼ�KSCN�������ټ�����ˮ��Һ��Ѫ��ɫ����Fe2+����μ�K3[Fe(CN)6]��Һ������ɫ�������ɣ�˵�������������ӣ���ȷ�𰸣�ȡ������Ӧ����ϲ���Һ���Թ��У��μӼ���K3[Fe(CN)6]��Һ������ɫ�������ɣ�˵����Ӧ����Fe2+���ɣ������KSCN�������ټ�����ˮ��Һ��Ѫ��ɫ����Fe2+����Ҳ������������֤����Ӧ����Һ����Fe2+���������ɡ���

 ����ʦ��Сһ����ʦ������ҵϵ�д�
����ʦ��Сһ����ʦ������ҵϵ�д� ���100�ֵ�Ԫ�Ż�������ϵ�д�
���100�ֵ�Ԫ�Ż�������ϵ�д�