题目内容
碳化铁(Fe3C)在冶金上称为渗碳体,为灰白色结晶粉末,与一定浓度的HNO3反应,生成Fe(NO3)3、NO2、NO、CO2和水.当产物中n(NO2):n(NO)=1:1时,下列说法正确的是( )
| A、反应中生成标况下2.24L CO2时转移电子数目为1.3NA |
| B、参加反应的Fe3C和HNO3的物质的量之比为1:9 |
| C、反应中产生CO2和NO2的体积比为1:4 |
| D、此反应中氧化剂是HNO3,氧化产物是NO2和NO |
考点:化学方程式的有关计算
专题:计算题
分析:假设碳化铁(Fe3C)中Fe、C元素化合价为0价,则Fe、C元素化合价升高总共为(3×3+4)=13,n(NO2):n(NO)=1:1,N元素化合价总共降低(3+1)=4,化合价升降最小公倍数为52,故Fe3C的系数为4,NO2、NO的系数为13,根据Fe原子守恒,则Fe(NO3)3的系数为12,由C原子守恒,则CO2的系数为4,由N原子守恒,HNO3的系数为62,故水的系数为31,配平方程式为:4Fe3C+62HNO3═12Fe(NO3)3+4CO2↑+13NO↑+13NO2↑+31H2O,反应中只有N元素化合价降低,NO2和NO是还原产物,根据N元素化合价计算注意电子数目,结合方程式解答B、C选项.
解答:
解:假设碳化铁(Fe3C)中Fe、C元素化合价为0价,则Fe、C元素化合价升高总共为(3×3+4)=13,n(NO2):n(NO)=1:1,N元素化合价总共降低(3+1)=4,化合价升降最小公倍数为52,故Fe3C的系数为4,NO2、NO的系数为13,根据Fe原子守恒,则Fe(NO3)3的系数为12,由C原子守恒,则CO2的系数为4,由N原子守恒,HNO3的系数为62,故水的系数为31,配平方程式为:4Fe3C+62HNO3═12Fe(NO3)3+4CO2↑+13NO↑+13NO2↑+31H2O,
A.反应中生成标况下2.24L CO2,其物质的量为0.1mol,反应中只有N元素化合价降低,由方程式可知生成NO、NO2的物质的量都是0.1mol×
,故转移电子为0.1mol×
×(3+1)×NAmol-1=1.3NA,故A正确;
B.由方程式可知,参加反应的Fe3C和HNO3的物质的量之比为4:62=2:31,故B错误;
C.由方程式可知,反应中产生CO2和NO2的体积比为4:13,故C错误;
D.反应中只有N元素化合价降低,氧化剂是HNO3,NO2和NO是还原产物,故D错误,
故选A.
A.反应中生成标况下2.24L CO2,其物质的量为0.1mol,反应中只有N元素化合价降低,由方程式可知生成NO、NO2的物质的量都是0.1mol×
| 13 |
| 4 |
| 13 |
| 4 |
B.由方程式可知,参加反应的Fe3C和HNO3的物质的量之比为4:62=2:31,故B错误;
C.由方程式可知,反应中产生CO2和NO2的体积比为4:13,故C错误;
D.反应中只有N元素化合价降低,氧化剂是HNO3,NO2和NO是还原产物,故D错误,
故选A.
点评:本题考查氧化还原反应基本概念、配平与计算等,题目难度较大,配平方程式是解题关键,侧重考查学生分析解决问题能力的考查,由于Fe3C中化合价不易确定,将元素化合价看作0价进行配平,注意掌握氧化还原反应配平的常用方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 某科研单位利用原电池原理,用SO2和O2来制备硫酸,装置如图所示,电极A、B为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触.下列有关该生产过程的叙述不正确的是( )
某科研单位利用原电池原理,用SO2和O2来制备硫酸,装置如图所示,电极A、B为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触.下列有关该生产过程的叙述不正确的是( )| A、该原电池的A为正极,B为负极 |
| B、B极的电极反应式为SO2+2H2O-2e-═SO42-+4H+ |
| C、溶液中H+的移动方向由A极到B极 |
| D、电池总反应式为2SO2+O2+2H2O═2H2SO4 |
向某NaOH溶液中通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同.若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系有如图所示四种情况,且(2)、(3)、(4)图中分别有OA<AB,OA=AB,OA>AB,则下列分析与判断不正确的是(不计CO2的溶解)( )
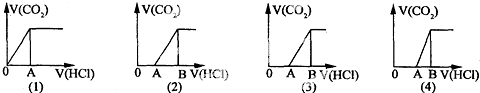

| A、M中只有一种溶质的有(1)和(3) |
| B、M中有两种溶质的有(2)和(4) |
| C、(2)图显示M中含有NaHCO3和Na2CO3两种溶质 |
| D、(4)图显示M中c(NaHCO3)>c(Na2CO3) |
下列实验现象所对应的离子方程式不正确的是( )
| A、向NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3 |
| B、向Ba(OH)2溶液中加入稀H2SO4恰好完全反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
| C、向稀NaOH溶液氯水中加入:Cl2+2OH-═Cl-+ClO-+H2O |
| D、向FeCl2溶液中加入少量K3[Fe(CN)3]溶液:3Fe2++2[Fe(CN)3]3-═Fe3[Fe(CN)2]2↓ |
下列仪器对应名称错误的是( )
A、 烧杯 |
B、 量筒 |
C、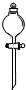 分液漏斗 |
D、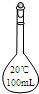 烧瓶 |
下列关于有机物的叙述正确的是( )
| A、汽油、柴油和植物油的成分都是碳氢化合物 |
| B、棉花和合成纤维的主要成分均为纤维素 |
| C、乙烯和苯蒸气都能使溴水褪色,不能鉴别乙烯和苯蒸气 |
| D、甲烷跟氯气在光照条件下的反应与乙酸、乙醇和浓硫酸共热时的反应类型相同 |
将质量为w1 g的钠、铝混合物投入一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体V1 L.向溶液中逐渐加入浓度为a mol/L的HCl溶液,反应过程中先有白色沉淀生成后又逐渐溶解,当沉淀恰好消失时所加HCl溶液体积为V2 L.将溶液蒸干灼烧得固体w2 g.下列关系式中正确的是( )
A、n(Na)+3n(Al)=
| ||
B、aV2=
| ||
| C、35.5aV2=w2-w1 | ||
| D、35.5aV2>(w2-w1) |
