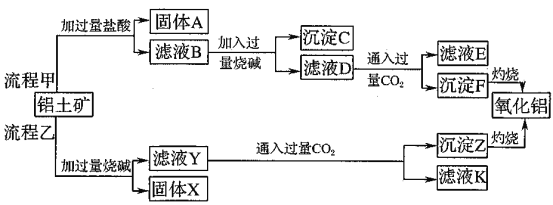
题目内容
【题目】(1)在25 ℃、101 kPa下,1 g液态甲醇燃烧生成CO2和液态水时放热22.68 kJ。则表示甲醇燃烧的热化学方程式为_______________。
(2)甲醇蒸气转化为氢气的一种原理是CH3OH和H2O反应生成CO2和H2。下图是该过程中能量变化示意图。
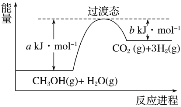
若在反应体系中加入催化剂,反应速率增大,正反应活化能a的变化是________(填“增大”、“减小”或“不变”),反应热ΔH的变化是________(填“增大”、“减小”或“不变”)。请写出反应进程CH3OH(g)和H2O(g)反应的热化学方程式_______________。
【答案】CH3OH(1)+![]() O2(g)=CO2(g)+2H2O(1) ΔH=-725.76 kJ·mol-1 减小 不变 CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=(a-b)kJ·mol-1
O2(g)=CO2(g)+2H2O(1) ΔH=-725.76 kJ·mol-1 减小 不变 CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=(a-b)kJ·mol-1
【解析】
(1)在25 ℃、101 kPa下,1 g液态甲醇燃烧生成CO2和液态水时放热22.68 kJ,因此1mol甲醇即32g甲醇燃烧反应生成二氧化碳和液态水放出热量为22.68 kJ×32 = 725.76 kJ,因此甲醇燃烧的热化学方程式为CH3OH(1)+![]() O2(g)=CO2(g)+2H2O(1) ΔH=-725.76 kJ·mol-1。
O2(g)=CO2(g)+2H2O(1) ΔH=-725.76 kJ·mol-1。
(2)反应体系中加入催化剂,降低了活化能,焓变不变,因此正反应活化能a的变化是减小,反应热ΔH的变化是不变;根据反应物活化能减去生成物活化能得到焓变,因此CH3OH(g)和H2O(g)反应的热化学方程式为CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g) ΔH=(a-b)kJ·mol-1。
CO2(g)+3H2(g) ΔH=(a-b)kJ·mol-1。

 轻松暑假总复习系列答案
轻松暑假总复习系列答案【题目】下列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如下表所示:
化学反应 | 平衡常数 | 温度 | |
973K | 1173K | ||
①Fe(s)+CO2(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) | K2 | 2.38 | 1.67 |
③CO(g)+H2O(g) | K3 | ? | ? |
则下列说法正确的是
A.△H1<0,△H2>0
B.反应①②③的反应热满足关系:△H2-△H1=△H3
C.反应①②③的平衡常数满足关系:K1·K2=K3
D.要使反应③在一定条件下建立的平衡向正反应方向移动,可采取升温措施