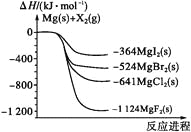
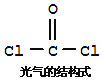
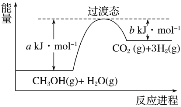
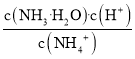题目内容
【题目】下列与金属腐蚀有关的说法正确的是( )
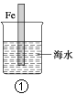
A.图①中,插入海水中的铁棒,越靠近底端腐蚀越严重
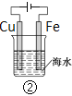
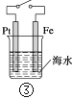
B.图②和④的装置中Fe电极均被保护
C.图③中,开关闭合时,Fe的腐蚀速率减小
D.在③开关闭合的情况下,四个装置中的Fe腐蚀速率由快到慢的顺序是:④③①②
【答案】D
【解析】
A选项,图①中,插入海水中的铁棒,在水和空气的交界处腐蚀越严重,故A错误;
B选项,图②中铁是阴极,受到保护,图④中Fe电极是阳极,受到腐蚀,故B错误;
C选项,图③中,开关闭合时,Fe作负极,腐蚀速度加快,故C错误;
D选项,在③开关闭合的情况下,①装置铁是一般的腐蚀,②装置铁为阴极,受到保护,③装置铁作负极,受到腐蚀加快,④装置是铁为阳极,加快腐蚀,腐蚀速率一般原则是电解池的阳极腐蚀 > 原电池负极的腐蚀 > 一般的腐蚀 > 原电池正极 > 电解池阴极,因此四个装置中的Fe腐蚀速率由快到慢的顺序是:④③①②,故D正确。
综上所述,答案为D。

 阅读快车系列答案
阅读快车系列答案【题目】海洋资源的开发与利用具有广阔的前景。海水的pH一般在7.5~8.6之间。某地海水中主要离子的含量如下表:
成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
含量/mgL-1 | 9360 | 83 | 160 | 1100 | 16000 | 1200 | 118 |
(1)海水显弱碱性的原因是(用离子方程式表示):____________,该海水中Ca2+的物质的量浓度为__________mol/L 。
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如下图所示。其中阴(阳)离子交换膜只允许阴(阳)离子通过,电极均为惰性电极。

① 开始时阳极的电极反应式为________________。
② 电解一段时间,____极(填“阴”或“阳”)会产生水垢,其成份为_____(填化学式)。
③ 淡水的出口为a、b、c中的__________出口。
(3)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如图所示:

该电池电解质为能传导 Li+的固体材料。
上面左图中的小黑点表示_____(填粒子符号),充电时该电极反应式为_______。
(4)利用海洋资源可获得MnO2 。MnO2可用来制备高锰酸钾:将MnO2与KOH混合后在空气中加热熔融,得到绿色的锰酸钾(K2MnO4),再利用氯气将锰酸钾氧化成高锰酸钾。该制备过程中消耗相同条件下氯气和空气的体积比为_________(空气中氧气的体积分数按20%计)。