题目内容
5.现有如下两个反应:a、NaOH+HCl=NaCl+H2O b、2FeCl3+Fe=3FeCl2(1)能设计成原电池的是b;
(2)如果不能,说明原因a不是氧化还原反应,没有发生电子的转移;
(3)如果可以,请画出实验装置图,注明选用的电极材料和电解质溶液名称,标出外电路导线中电子流动方向和电流方向(用“$\stackrel{电子}{→}$”、“$\stackrel{电流}{→}$”表示),写出电极反应式.
| 实验装置图 | 负极反应式:Fe-2e-=Fe2+; 正极反应式:2Fe3++2e-=2Fe2+. |
分析 (1)原电池反应是自发进行的放热的氧化还原反应;
(2)原电池反应是自发进行的放热的氧化还原反应;
(3)该原电池反应中,Fe元素化合价由0价、+3价变为+2价,所以Fe失电子发生氧化反应,则Fe作负极,不如铁活泼的金属或导电的非金属作正极,氯化铁溶液为电解质溶液,电子从负极沿导线流向正极,电流与电子流向相反.
解答 解:(1)原电池反应是自发进行的放热的氧化还原反应,a中各元素化合价不变,不属于氧化还原反应,所以不能设计成原电池,b中Fe元素化合价发生变化,所以可以设计成原电池,故答案为:b;
(2)a不是氧化还原反应,没有发生电子的转移,所以不能设计成原电池,故答案为:a不是氧化还原反应,没有发生电子的转移;
(3)该原电池反应中,Fe元素化合价由0价、+3价变为+2价,所以Fe失电子发生氧化反应,则Fe作负极,不如铁活泼的金属或导电的非金属作正极,氯化铁溶液为电解质溶液,电子从负极沿导线流向正极,电流与电子流向相反,Fe是负极、Cu是正极,电子从Fe沿导线流向Cu,电流从Cu沿导线流向Fe,实验装置图如右图所示: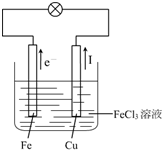
正极上铜离子得电子发生还原反应,电极反应式为:2Fe3++2e-=2Fe2+;
负极上铁失电子发生氧化反应,电极反应式为:Fe-2e-=Fe2+,
故答案为: ;Fe-2e-=Fe2+;2Fe3++2e-=2Fe2+;
;Fe-2e-=Fe2+;2Fe3++2e-=2Fe2+;
点评 本题考查原电池设计,侧重考查学生知识运用能力及实验方案设计能力,明确原电池原理是解本题关键,会根据电池反应式确定正负极及电解质溶液,题目难度不大.

练习册系列答案
相关题目
16.下列各组物质发生化学反应时,由于反应物的量不同而生成不同产物的是( )
①CO2与NaOH溶液 ②NaHCO3溶液与盐酸 ③Na与氧气 ④C与O2 ⑤AlCl3溶液与氨水.
①CO2与NaOH溶液 ②NaHCO3溶液与盐酸 ③Na与氧气 ④C与O2 ⑤AlCl3溶液与氨水.
| A. | 除③外 | B. | 除①④外 | C. | 除②③⑤外 | D. | 除②外 |
14.下列有关说法不正确的是( )
| A. | 物质的量表示含有一定数目粒子的集合体 | |
| B. | 物质的量是联系微观粒子和宏观物质的物理量 | |
| C. | 0.012kg 12C中所含碳原子数约为6.02×1023 | |
| D. | 物质的量可用于表示宏观物质的多少 |
15.下列表示物质或微粒的化学用语或模型正确的是( )
| A. | 氮气分子的结构式:N-N | B. | Mg2+的结构示意图: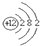 | ||
| C. | 乙醇的结构简式:CH3CH2OH | D. | 二氧化碳电子: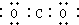 |