题目内容
17.0.5molH2SO4的质量是49g,含3.01×1023个分子,含2mol氧原子,能和1_mol NaOH完全反应,该硫酸所含氢元素的质量与36.5g HCl中所含氢元素的质量相同.分析 根据m=nM计算硫酸的质量,根据N=nNA计算硫酸分子数目,氧原子物质的量为硫酸的4倍,由2NaOH+H2SO4=Na2SO4+2H2O,可知消耗氢氧化钠的物质的量为硫酸的2倍;含有氢元素质量相同,则氢原子物质的量相等,据此计算HCl物质的量,再根据m=nM计算HCl的质量.
解答 解:0.5molH2SO4的质量是0.5mol×98g/mol=49g,含硫酸分子数目为0.5mol×6.02×1023mol-1=3.01×1023,含氧原子物质的量为0.5mol×4=2mol,由2NaOH+H2SO4=Na2SO4+2H2O,可知中和氢氧化钠为0.5mol×2=1mol,与之含氢元素质量相等的HCl的物质的量为0.5mol×2=1mol,则HCl的质量为1mol×36.5g/mol=36.5g,
故答案为:49;3.01×1023;2;1;36.5.
点评 本题考查物质的量有关计算,比较基础,旨在考查学生对基础知识的理解掌握.

练习册系列答案
相关题目
8.化学与社会、生产、生活紧切相关.下列说法不正确的是( )
| A. | 人体缺铁会引起贫血等疾病 | |
| B. | 任何条件下,铝不与浓硫酸、浓硝酸反应,因此浓硫酸、浓硝酸可储存于铝制的容器中 | |
| C. | 明矾溶于水会产生氢氧化铝胶体,故可用作净水剂 | |
| D. | 铜盐能杀死某些细菌,并能抑制藻类生长,因此游泳场馆常用硫酸铜作池水消毒剂 |
5.现有如下两个反应:a、NaOH+HCl=NaCl+H2O b、2FeCl3+Fe=3FeCl2
(1)能设计成原电池的是b;
(2)如果不能,说明原因a不是氧化还原反应,没有发生电子的转移;
(3)如果可以,请画出实验装置图,注明选用的电极材料和电解质溶液名称,标出外电路导线中电子流动方向和电流方向(用“$\stackrel{电子}{→}$”、“$\stackrel{电流}{→}$”表示),写出电极反应式.
(1)能设计成原电池的是b;
(2)如果不能,说明原因a不是氧化还原反应,没有发生电子的转移;
(3)如果可以,请画出实验装置图,注明选用的电极材料和电解质溶液名称,标出外电路导线中电子流动方向和电流方向(用“$\stackrel{电子}{→}$”、“$\stackrel{电流}{→}$”表示),写出电极反应式.
| 实验装置图 | 负极反应式:Fe-2e-=Fe2+; 正极反应式:2Fe3++2e-=2Fe2+. |
2.已知下述三个实验中的物质均能发生化学反应.
下列判断正确的是( )
| ① | ② | ③ |
| 将铁钉放入硫酸铜溶液中 | 向硫酸亚铁溶液中滴入几滴浓硝酸 | 将铁钉放入氯化铁溶液中 |
| A. | 实验①和③中的铁钉只作还原剂 | |
| B. | 上述实验证明氧化性:Fe3+>Fe2+>Cu2+ | |
| C. | 实验②中Fe2+既显氧化性又显还原性 | |
| D. | 实验③中反应的离子方程式为Fe+Fe3+═2Fe2+l- |
9.1998年出现的全球温度大幅度升高,产生了显著的“厄尔尼诺”现象,干旱和暴雨灾难危害了许多地区.为了防止气候变暖的进一步恶化,联合国环境保护组织于1998年通过大会要求各国减少工业排放量的气体是( )
| A. | 二氧化硫 | B. | 二氧化碳 | C. | 氮的氧化物 | D. | 氟里昂 |
6.设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 3 mol NF3与水完全反应生成HNO3和NO,转移电子数为2NA | |
| B. | 4.4 g14CO2含中子数为2.4NA | |
| C. | 标准状况下,2.24 L Cl2通入足量NaOH溶液中,反应转移电子的数目为0.2NA | |
| D. | 常温常压下,1.7 g H2O2中含有的电子数为NA |
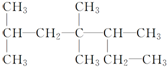 2,4,4,5-四甲基庚烷
2,4,4,5-四甲基庚烷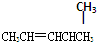 2-戊烯
2-戊烯