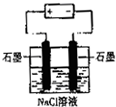
题目内容
用高铁酸钠(Na2FeO4)对饮用水处理是新技术.已知制备高铁酸钠的一种方法是:Fe2O3+3Na2O2  2Na2FeO4+Na2O,下列说法正确的是
2Na2FeO4+Na2O,下列说法正确的是
- A.Na2O2是氧化剂
- B.该反应属于复分解反应
- C.3molNa2O2发生反应,有12mol电子转移
- D.在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌
A
分析:首先判断元素的化合价,从化合价变化的角度分析氧化还原反应,根据化合价的变化判断电子转移的数目并判断物质的性质.
解答:A.反应中Fe元素的化合价由+3价升高到+6价,Na2FeO4被氧化,Na2O2中O元素的化合价由-1价变为-2价,被还原,Na2O2为氧化剂,故A正确;
B.Fe和O元素的化合价变化,属于氧化还原反应,故B错误;
C.Na2O2中O元素的化合价由-1价变为-2价,3molNa2O2发生反应,转移电子的物质的量为3mol×2×1=6mol,故C错误;
D.Na2FeO4中Fe为+6价,故D错误.
故选A.
点评:本题考查氧化还原反应,题目难度不大,本题注意从化合价变化的角度分析.
分析:首先判断元素的化合价,从化合价变化的角度分析氧化还原反应,根据化合价的变化判断电子转移的数目并判断物质的性质.
解答:A.反应中Fe元素的化合价由+3价升高到+6价,Na2FeO4被氧化,Na2O2中O元素的化合价由-1价变为-2价,被还原,Na2O2为氧化剂,故A正确;
B.Fe和O元素的化合价变化,属于氧化还原反应,故B错误;
C.Na2O2中O元素的化合价由-1价变为-2价,3molNa2O2发生反应,转移电子的物质的量为3mol×2×1=6mol,故C错误;
D.Na2FeO4中Fe为+6价,故D错误.
故选A.
点评:本题考查氧化还原反应,题目难度不大,本题注意从化合价变化的角度分析.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案
相关题目
A、B、C、D、E、均为可溶于水的固体,所得的溶液只有E溶液有颜色.取一定量的固体C放在试管中用酒精灯加热,固体的质量会减少.组成这五种物质的离子有(各物质所含的离子均不相同)
| 阳离子 | Na+ Mg2+ Al3+ Ba2+ Fe3+ |
| 阴离子 | OH- Cl- 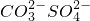 HCO3- HCO3- |
①A溶液分别其他四种溶液反应,均有沉淀;
②B溶液分别与其四种溶液反应,也有沉淀;只是当B溶液加入到D溶液中时,先有沉淀继续加入B溶液时,沉淀会消失.据此推断它们是A________;B________;C________;D________;E________.