题目内容
3.下列微粒中,电子数大于质子数,质子数大于中子数的是( )| A. | D3O+ | B. | N3- | C. | OH- | D. | NH${\;}_{4}^{+}$ |
分析 电子数大于质子数则微粒带负电,氢原子没有中子,据此解题.
解答 解:电子数大于质子数则微粒带负电.
A.D3O+带正电,故A错误;
B.N原子质子数等于中子数=7,N3-质子数=中子数,故B错误;
C.氧原子质子数等于电子数都是8,H的原子中只有质子无中子,故OH-的质子数大于中子数,故C正确;
D.NH${\;}_{4}^{+}$带正电,故D错误.
故选C.
点评 本题考查原子结构,明确质子数、中子数、核外电子数及其相互联系是解题的关键,难度不大.

练习册系列答案
相关题目
13.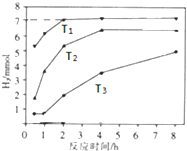 在一定温度下,向容积为2L的密闭容器中加入1mol A和2mol B,发生如下反应:A(g)+2B(g)?2C(g)△H,经5min达到平衡时,生成0.4mol C,下列叙述中正确的是( )
在一定温度下,向容积为2L的密闭容器中加入1mol A和2mol B,发生如下反应:A(g)+2B(g)?2C(g)△H,经5min达到平衡时,生成0.4mol C,下列叙述中正确的是( )
 在一定温度下,向容积为2L的密闭容器中加入1mol A和2mol B,发生如下反应:A(g)+2B(g)?2C(g)△H,经5min达到平衡时,生成0.4mol C,下列叙述中正确的是( )
在一定温度下,向容积为2L的密闭容器中加入1mol A和2mol B,发生如下反应:A(g)+2B(g)?2C(g)△H,经5min达到平衡时,生成0.4mol C,下列叙述中正确的是( )| A. | 反应的平均速率v(A)=0.04 mol/(L•min) | |
| B. | 达平衡时A、B的转化率相等 | |
| C. | 向平衡混合物中再加入0.1 mol A、0.2 mol B,达新平衡时C的体积分数减小 | |
| D. | 若升高温度达新平衡后,A的浓度增大,则△H>0 |
14.分子式为C5H10O2,能与NaOH反应且有3个甲基的同分异构体共有(不考虑立体异构)( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
18.已知0.1mol•L-1的二元酸H2A溶液的pH=4.0,则下列说法中正确的是( )
| A. | 在Na2A、NaHA两溶液中,离子种类相同 | |
| B. | 在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等 | |
| C. | NaHA溶液pH一定大于7 | |
| D. | 在Na2A溶液中一定有:c(Na+)>c(A2-)>c(H+)>c(OH-) |
16.下列说法不正确的是( )
| A. | 麦芽糖及其水解产物均能发生银镜反应 | |
| B. | 某物质的结构为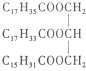 ,与其互为同分异构且完全水解后产物相同的油脂有两种 ,与其互为同分异构且完全水解后产物相同的油脂有两种 | |
| C. | 用溴水即可鉴别四氯化碳、2-己烯和甲苯 | |
| D. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
17.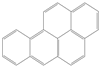 柴静在《穹顶之下》中介绍到雾霾中含有较大量的一种突变原和致癌物质--苯并[a]芘(Benzo-a-pyrene)(BAP).苯并芘是一种五环多环芳香烃类(结构如图所示),存在于汽车废气(尤其是柴油引擎)、烟草与木材燃烧产生的烟,以及炭烤食物中.关于苯并[a]芘的下列说法中正确的是( )
柴静在《穹顶之下》中介绍到雾霾中含有较大量的一种突变原和致癌物质--苯并[a]芘(Benzo-a-pyrene)(BAP).苯并芘是一种五环多环芳香烃类(结构如图所示),存在于汽车废气(尤其是柴油引擎)、烟草与木材燃烧产生的烟,以及炭烤食物中.关于苯并[a]芘的下列说法中正确的是( )
 柴静在《穹顶之下》中介绍到雾霾中含有较大量的一种突变原和致癌物质--苯并[a]芘(Benzo-a-pyrene)(BAP).苯并芘是一种五环多环芳香烃类(结构如图所示),存在于汽车废气(尤其是柴油引擎)、烟草与木材燃烧产生的烟,以及炭烤食物中.关于苯并[a]芘的下列说法中正确的是( )
柴静在《穹顶之下》中介绍到雾霾中含有较大量的一种突变原和致癌物质--苯并[a]芘(Benzo-a-pyrene)(BAP).苯并芘是一种五环多环芳香烃类(结构如图所示),存在于汽车废气(尤其是柴油引擎)、烟草与木材燃烧产生的烟,以及炭烤食物中.关于苯并[a]芘的下列说法中正确的是( )| A. | BAP导电性优良,因其有共轭双键结构 | |
| B. | 五环多环芳香烃类都是BAP的同分异构体 | |
| C. | BAP有10种一硝基取代物 | |
| D. | BAP的分子式为C20H12 |
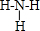 ,D2C含有的化学键类型为离子键;
,D2C含有的化学键类型为离子键;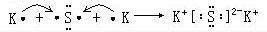 ;
;