题目内容
将0.01mol/L的盐酸溶液和未知浓度的NaOH溶液以1:2的体积比混和,所得溶液的pH值=12,用上述NaOH溶液滴定pH=3的某一元弱酸溶液20mL,达到终点时消耗NaOH溶液12.5mL,试求:
(1)NaOH溶液的物质的量的浓度______;
(2)此一元弱酸的物质的量的浓度______;
(3)此一元弱酸的电离度______.
解:(1)溶液的pH为12,则盐酸过量,则NaOH过量,利用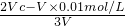 =0.01mol/L,解得c(NaOH)=0.02 mol?L-1,
=0.01mol/L,解得c(NaOH)=0.02 mol?L-1,
故答案为:0.02mol/L;
(2)恰好中和时,c(弱酸)×0.02L=c(NaOH)×0.0125L,则c(弱酸)=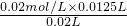 =0.0125 mol?L-1,
=0.0125 mol?L-1,
故答案为:0.0125 mol?L-1;
(3)已知弱酸溶液pH为3,则弱酸中c(H+)=10-3mol/L,又因为c(弱酸)=0.0125 mol?L-1,所以弱酸的电离度=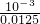 ×100%=8%,
×100%=8%,
故答案为:8%.
分析:(1)溶液的pH为12,则NaOH过量,利用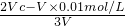 =0.01mol/L计算;
=0.01mol/L计算;
(2)恰好中和时,c(弱酸)×0.02L=c(NaOH)×0.0125L;
(3)弱酸的pH为3,则弱酸中c(H+)=10-3mol/L再根据弱酸的浓度求算.
点评:本题考查酸碱混合的计算,明确混合后溶液的pH判断过量是解答的关键,注意结合题目中的信息解答,题目难度不大.
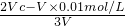 =0.01mol/L,解得c(NaOH)=0.02 mol?L-1,
=0.01mol/L,解得c(NaOH)=0.02 mol?L-1,故答案为:0.02mol/L;
(2)恰好中和时,c(弱酸)×0.02L=c(NaOH)×0.0125L,则c(弱酸)=
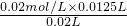 =0.0125 mol?L-1,
=0.0125 mol?L-1,故答案为:0.0125 mol?L-1;
(3)已知弱酸溶液pH为3,则弱酸中c(H+)=10-3mol/L,又因为c(弱酸)=0.0125 mol?L-1,所以弱酸的电离度=
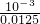 ×100%=8%,
×100%=8%,故答案为:8%.
分析:(1)溶液的pH为12,则NaOH过量,利用
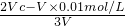 =0.01mol/L计算;
=0.01mol/L计算;(2)恰好中和时,c(弱酸)×0.02L=c(NaOH)×0.0125L;
(3)弱酸的pH为3,则弱酸中c(H+)=10-3mol/L再根据弱酸的浓度求算.
点评:本题考查酸碱混合的计算,明确混合后溶液的pH判断过量是解答的关键,注意结合题目中的信息解答,题目难度不大.

练习册系列答案
相关题目
下列述叙正确的是( )
| A、取一小块铝箔用砂纸打磨除去表面的氧化膜后,在酒精灯上加热灼烧,可看到铝箔燃烧起来火星四溅 | B、Mg(OH)2的悬浊液中加入NH4Cl溶液后变澄清,是因为Mg(OH)2的Ksp在NH4Cl溶液中变大 | C、将0.01mol/L KMnO4的酸性溶液滴入0.1mol/L H2C2O4溶液中,紫红色褪去的速率会逐渐加快 | D、将一小块铜片放入盛有浓硫酸的试管中加热反应后的溶液呈蓝色 |
 在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示.又知AgCl的Ksp=1.8×10-10.下列说法不正确的是( )
在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示.又知AgCl的Ksp=1.8×10-10.下列说法不正确的是( )