题目内容
【题目】汽车内燃机工作时会引起N2和O2的反应:N2+O2![]() 2NO,是导致汽车尾气中含有NO的原因之一。
2NO,是导致汽车尾气中含有NO的原因之一。
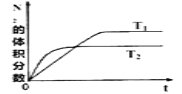
(1)在T1、T2温度下,一定量的NO(g)发生分解反应时,N2的体积分数随时间变化如图所示,根据图像判断反应N2(g)+O2(g)![]() 2NO(g)的△H_____0(填“>"或“<”)。
2NO(g)的△H_____0(填“>"或“<”)。
(2)在T3温度下,向2L密闭容器中充入10molN2与5molO2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率v(N2)=_________。该温度下,若增大压强此反应的平衡常数将_________(填“增大”、“减小”、“不变”或“无法确定”),若向上述容器中再充入2molN2(g)与1molO2(g),则再次达到平衡时O2的转化率________(填“增大”、“减小”、“不变”或“无法确定”)。
(3)研究发现,用CH4催化还原NOx可以消除氮氧化物的污染,从而达到脱硝的目的:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJmol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJmol-1
甲烷直接被NO2还原为N2的热化学方程式为______________________________
【答案】 > 0.01mol/(L·s) 不变 不变 CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) H=-867 kJ·mol-1
【解析】(1)根据图像可知,T2温度可逆反应先达平衡,说明温度T2>T1;T1向T2转变,即升温过程中,N2的体积分数减小,说明平衡正向移动,即正向为吸热反应,△H>0;正确答案:>。
(2) 2L密闭容器 N2(g)+O2(g)![]() 2NO(g)
2NO(g)
起始量:10 5 0
变化量:1 1 2
平衡量:9 4 2
v(N2)=1÷2÷50=0.01mol/(L·s);平衡常数只是温度的函数,温度不变,平衡常数不变;
其他条件不变,按照原物质投料方式进行等比例增加投料,相当于给反应加压,由于该反应为反应前后体积变化为0的反应,加压,平衡不动,O2转化率不变;正确答案:0.01mol/(L·s); 不变; 不变。
(3)根据盖斯定律,把两个方程式直接相加和,整理,并计算相应的△H,得出甲烷直接被NO2还原为N2的热化学方程式;正确答案:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) H=-867 kJ·mol-1。

 小题狂做系列答案
小题狂做系列答案