题目内容
【题目】下表为长式周期表的一部分,其中的编号代表对应的元素。
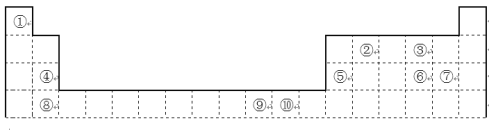
请回答下列问题:
(1)表中属于ds区的元素是(填编号)____________。
(2)元素②与③形成的一种化合物是重要的化工原料,该化合物可用于人工降雨.有关该化合物分子的说法正确的是______。
A.分子中含极性共价键 B.含有1个σ键和2个π键 C.属于非极性分子 D.该化合物分子中,②原子采用sp2杂化
(3)根据上述表格中的十种元素填空:
I.金属性最强的主族元素是_______(填元素名称);
II.⑤、⑥、⑦的离子半径由小到大的顺序是_____(填化学式);
III.⑥、⑦两种元素的最高价氧化物对应的水化物的酸性由大到小的顺序是____(填化学式)。
(4)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为_;该元素与元素①形成的分子X的空间构型为_。
【答案】⑩ AC 钙 ![]()
![]() 1 三角锥形
1 三角锥形
【解析】
根据周期表结构可知各元素分别为①H;②C;③O;④Mg;⑤Al;⑥S;⑦Cl;⑧Ca;⑨Ni;⑩Cu,据此解答;
(1)周期表中IB和IIB属于ds区,上述元素中Cu在IB属于ds区,故答案为:⑩;
(2) 元素②与③形成的化合物可用于人工降雨该物质是二氧化碳,二氧化碳中心碳原子的价电子数=![]() ,采用sp杂化方式,空间结构为直线型,正负电荷重心重合,属于非极性分子,其结构为O=C=O,碳氧之间为极性共价键,1个双键中有1个σ键和1个π键,则二氧化碳中含有2个σ键和2个π键;故正确的是AC,
,采用sp杂化方式,空间结构为直线型,正负电荷重心重合,属于非极性分子,其结构为O=C=O,碳氧之间为极性共价键,1个双键中有1个σ键和1个π键,则二氧化碳中含有2个σ键和2个π键;故正确的是AC,
故答案为:AC;
(3) I.金属性同周期元素从左到右依次减弱,同主族从上到下依次增强,上述元素中金属性最强的是钙,故答案为:钙;
II.离子的电子层数越多半径越大,电子层数相同时核电荷数越多半径越小,⑤、⑥、⑦的离子分别为铝离子、硫离子和氯离子,半径大小为![]() ,故答案为:
,故答案为:![]() ;
;
III.⑥、⑦两种元素分别为硫元素和氯元素,非金属越强最高价氧化物的水化物酸性越强,氯、硫同周期,非金属性:Cl>S,则![]() ,故答案为:
,故答案为:![]() ;
;
(4)某元素的特征电子排布式为nsnnpn+1,因s轨道只能容纳2个电子,则n=2,该元素为:2s22p3,为氮元素,原子的核外最外层电子有1对孤对电子,该元素与元素①形成的分子为NH3,氨气为三角锥形分子,故答案为:1;三角锥形;

【题目】化学知识无处不在,下列与古诗文记载对应的化学知识不正确的是![]()
![]()
常见古诗文记载 | 化学知识 | |
A | 《荀子劝学》:冰水为之,而寒于水。 | 冰的能量低于水,冰变为水属于吸热反应 |
B | 《泉州府志》:元时南安有黄长者为宅煮糖,宅垣忽坏,去土而糖白,后人遂效之。 | 泥土具有吸附作用,能将红糖变白糖 |
C | 《天工开物》:凡研硝(KNO3)不以铁碾入石臼,相激火生,祸不可测。 | 性质不稳定,撞击易爆炸 |
D | 《本草纲目》:釆蒿蓼之属,晒干烧灰,以原水淋汁,久则凝淀如石(石碱),浣衣发面。 | 石碱具有碱性,遇酸产生气体 |
A.AB.BC.CD.D