题目内容
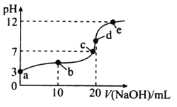
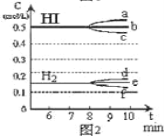
【题目】25℃时,用NaOH溶液滴定H2C2O4溶液,溶液中-1g[c(H+)/c(H2C2O4)]和-1gc(HC2O4-)或-1g[c(H+)/c(HC2O4-)]和-1gc(C2O42-)关系如图所示。下列说法不正确的是
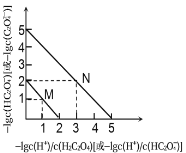
A. Ka1(H2C2O4)的数量级为10-2
B. 曲线M表示-1g[c(H+)/c(H2C2O4)]和-1gc(HC2O4-)的关系
C. 向NaHC2O4溶液中加NaOH至c(HC2O4-)和c(C2O42-)相等,此时溶液pH约为5
D. 在NaHC2O4溶液中c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
【答案】D
【解析】
本题主要考查电解质相关知识。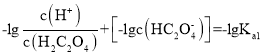 ,同理
,同理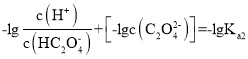 ,因
,因![]() ,故曲线M表示
,故曲线M表示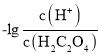 和
和![]() 的关系,曲线N表示
的关系,曲线N表示 和
和![]() 的关系,由此分析各选项正误。
的关系,由此分析各选项正误。
A. 由上述分析可知,曲线M表示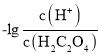 和
和![]() 的关系,Ka1=
的关系,Ka1=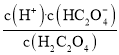 ,根据曲线M上的数值Ka1=10-1×10-1=10-2,曲线N表示
,根据曲线M上的数值Ka1=10-1×10-1=10-2,曲线N表示 和
和![]() 的关系,根据曲线N上的数值Ka2=
的关系,根据曲线N上的数值Ka2= =10-2×10-3=10-5,故A项正确;
=10-2×10-3=10-5,故A项正确;
B. 由上述分析可知,故曲线M表示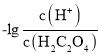 和
和![]() 的关系,故B项正确;
的关系,故B项正确;
C.当![]() 时,Ka2=
时,Ka2= =10-5,
=10-5,![]() ,故pH为5,C项正确;
,故pH为5,C项正确;
D.HC2O4-在溶液中既存在电离平衡又存在水解平衡,HC2O4-水解的离子方程式为HC2O4-+H2O![]() H2C2O4+OH-,HC2O4-水解平衡常数为
H2C2O4+OH-,HC2O4-水解平衡常数为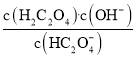 =Kw/Ka1=
=Kw/Ka1=![]() =1×10-12<Ka2,HC2O4-的电离程度大于水解程度,NaHC2O4溶液呈酸性,故
=1×10-12<Ka2,HC2O4-的电离程度大于水解程度,NaHC2O4溶液呈酸性,故![]() ,D项错误。
,D项错误。
答案选D。

【题目】根据下列实验现象所得出的结论正确的是
选项 | 实验现象 | 实验结论 |
A | 将铝片分别投入浓、稀硝酸中,前者无明显现象,后者反应剧烈 | 稀硝酸的氧化性比浓硝酸的强 |
B | 滴有酚酞的Na2CO3溶液中加入BaCl2溶液,红色变浅 | Na2CO3溶液中存在水解平衡 |
C | 某溶液中滴加过量氨水产生白色沉淀且不溶解 | 该溶液中一定含有Mg2+ |
D | 溴水中通入SO2,溴水褪色 | SO2具有漂白性 |
A. A B. B C. C D. D