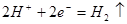题目内容
(16分)2006年世界锂离子电池总产量超过25亿只,锂电池消耗量巨大,对不可再生的金属资源的消耗是相当大的,回收利用锂资源成为重要课题。某研究小组对某废旧锂离子电池正极材料(图中简称废料,成份为LiMn2O4、石墨粉和铝箔)进行回收研究,工艺流程如下:
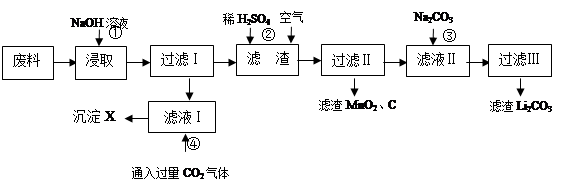
已知:Li2SO4、LiOH和Li2CO3在303K下的溶解度分别为34.2g、12.7g和1.3g。
(1)废料在用NaOH溶液浸取之前需要进行粉碎操作,其目的是 。
(2)废旧电池可能由于放电不完全而残留有锂单质,为了安全对拆解环境的要求______ __ 。
(3)写出反应④生成沉淀X的离子方程式:
。
(4)己知LiMn2O4中Mn的化合价为+3和+4价,写出反应②的离子反应方程式:
。
(5)生成Li2CO3的化学反应方程式为______ __。已知Li2CO3在水中的溶解度随着温度升高而减小,最后一步过滤时应_ _。

已知:Li2SO4、LiOH和Li2CO3在303K下的溶解度分别为34.2g、12.7g和1.3g。
(1)废料在用NaOH溶液浸取之前需要进行粉碎操作,其目的是 。
(2)废旧电池可能由于放电不完全而残留有锂单质,为了安全对拆解环境的要求______ __ 。
(3)写出反应④生成沉淀X的离子方程式:
。
(4)己知LiMn2O4中Mn的化合价为+3和+4价,写出反应②的离子反应方程式:
。
(5)生成Li2CO3的化学反应方程式为______ __。已知Li2CO3在水中的溶解度随着温度升高而减小,最后一步过滤时应_ _。
(1)增大接触面积,加快反应速率(2分)
(2)隔绝空气和水分(2分)
(3)CO2+AlO2–+2H2O=Al(OH)3↓+HCO3–(3分)
(4)4 LiMn2O4+4 H++O2=8MnO2+4 Li++2H2O(4分)
(5) Li2SO4+Na2CO3=Na2SO4+Li2CO3↓ (3分) 趁热过滤(2分)
(2)隔绝空气和水分(2分)
(3)CO2+AlO2–+2H2O=Al(OH)3↓+HCO3–(3分)
(4)4 LiMn2O4+4 H++O2=8MnO2+4 Li++2H2O(4分)
(5) Li2SO4+Na2CO3=Na2SO4+Li2CO3↓ (3分) 趁热过滤(2分)
(1)进行粉碎操作可以增大反应物的接触面积,加快反应速率。
(2)锂是活泼的金属,极易和水及氧气反应,所以需要隔绝空气和水分。
(3)滤液中含有偏铝酸钠,所以通入CO2能生成氢氧化铝沉淀,方程式为CO2+AlO2–+2H2O=Al(OH)3↓+HCO3–。
(4)LiMn2O4中Mn的化合价为+3和+4价,则+3价的被氧化生成二氧化锰,方程式为4 LiMn2O4+4 H++O2=8MnO2+4 Li++2H2O。
(5)Li2CO3的溶解度小于硫酸锂的,因此硫酸锂和碳酸钠反应可以生成碳酸锂沉淀,所以方程式为Li2SO4+Na2CO3=Na2SO4+Li2CO3↓。由于Li2CO3在水中的溶解度随着温度升高而减小,最后一步过滤时应趁热过滤。
(2)锂是活泼的金属,极易和水及氧气反应,所以需要隔绝空气和水分。
(3)滤液中含有偏铝酸钠,所以通入CO2能生成氢氧化铝沉淀,方程式为CO2+AlO2–+2H2O=Al(OH)3↓+HCO3–。
(4)LiMn2O4中Mn的化合价为+3和+4价,则+3价的被氧化生成二氧化锰,方程式为4 LiMn2O4+4 H++O2=8MnO2+4 Li++2H2O。
(5)Li2CO3的溶解度小于硫酸锂的,因此硫酸锂和碳酸钠反应可以生成碳酸锂沉淀,所以方程式为Li2SO4+Na2CO3=Na2SO4+Li2CO3↓。由于Li2CO3在水中的溶解度随着温度升高而减小,最后一步过滤时应趁热过滤。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
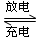 2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法中正确的是 (填序号)
2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法中正确的是 (填序号)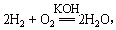 则负极反应式为___ _____________ _,正极反应式为 。一段时间后,KOH溶液的浓度 (填“变大”、“变小”或“不变”)
则负极反应式为___ _____________ _,正极反应式为 。一段时间后,KOH溶液的浓度 (填“变大”、“变小”或“不变”)