题目内容
某化学课外活动小组欲制取纯Na2CO3溶液并讨论实验过程中的相关问题.三名同学设计的制备实验方案的反应流程分别如下:
 请回答下列问题:
请回答下列问题:
(1)请指出甲.乙两方案的主要缺点:
甲方案______________.
乙方案______________.
(2)假设反应②所得的Na2CO3固体中混有未分解的NaHCO3.乙同学选择澄清石灰水测定其中NaHCO3的质量分数,请说明其计算所需的数据;若不能,请简要说明理由:
______________.
(3)若采用丙方案制取纯Na2CO3溶液,其实验的关键有________.
(4)按如下实验步骤具体实施丙方案
①用25 mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解.
②小心煮沸溶液1 min-2 min.
③在得到的溶液中再加入25 mL NaOH溶液,使溶液充分混合.
请回答下列问题:
A.第①步实验装置如图,装置A中使用的试剂是石灰石和盐酸溶液.装置B使用的试剂是________,作用是________.

B.有人认为实验步骤②、③的顺序应对调,即先混合再煮沸更合理,你认为对吗?________.为什么?__________________________.
解析:
(1)甲:通入CO2的难以控制适量
乙:加热蒸干过程慢、浪费燃料,且不便于使NaHCO3完全分解
(2)不能 澄清石灰水既能与Na2CO3反应生成CaCO3,又能与NaHCO3反应生成CaCO3.
(3)①通入NaOH溶液的CO2要过量,且完全反应后要煮沸溶液;
②确保前后两份NaOH溶液浓度、体积均相同.
(4)A:饱和NaHCO3溶液;吸收挥发出的HCl气体.
B:不对
若先混合溶液,会使溶液中的H2CO3与NaOH反应,使NaHCO3有剩余,所得Na2CO3溶液中必然含有NaHCO3.

物质名称 | 溶解度/g |
NaOH | 110 |
Na2CO3 | 30 |
NaHCO3 | 9 |
(1)用化学方程式表示其制备过程;
(2)若耗用100 g水需NaOH物质的量为____________ mol;
(3)简述实验操作过程;
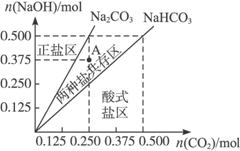
(4)上述上图为该实验过程中的图象,请在图中标出A点,即当n(CO2)∶n(NaOH)=2∶3,且n(CO2)=0.250 mol 时的位置,并由此判断此时所得盐的组成,计算其物质的量。

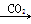 Na2CO3溶液
Na2CO3溶液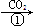 NaHCO3溶液
NaHCO3溶液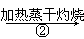 Na2CO3固体
Na2CO3固体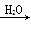 Na2CO3溶液
Na2CO3溶液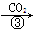 NaHCO3溶液
NaHCO3溶液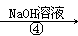 Na2CO3溶液
Na2CO3溶液