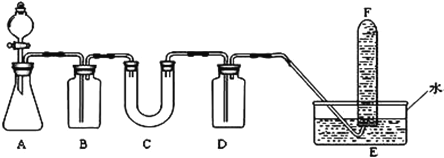
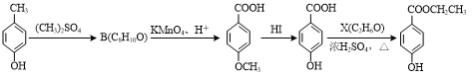
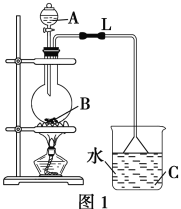
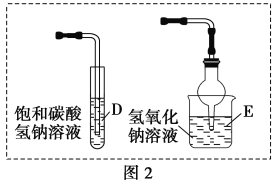
题目内容
【题目】(1)在标准状况下,1.7g氨气所占的体积为__L,它与标准状况下__L硫化氢含有相同数目的氢原子。
(2)同温同压下,SO2与氦气的密度之比为___;若质量相同,则两种气体的体积之比为___;若体积相同,两种气体的质量之比为___。
(3)在标准状况下,①4gH2;②11.2LO2;③1molH2O中,所含分子数最多的是(填序号,下同)___,含原子数最多的是___,质量最大的是___,体积最小的是___。
【答案】2.24 3.36 16∶1 1∶16 16∶1 ① ① ③ ③
【解析】
(1)根据![]() 计算得NH3的物质的量
计算得NH3的物质的量![]() ,标准状况下Vm=22.4L/mol,故氨气体积V=0.1×22.4L=2.24L。0.1molNH3含有0.3molH原子,与0.15molH2S中含有的H原子数目相同,0.15molH2S的气体体积为V=0.15×22.4L=3.36L;
,标准状况下Vm=22.4L/mol,故氨气体积V=0.1×22.4L=2.24L。0.1molNH3含有0.3molH原子,与0.15molH2S中含有的H原子数目相同,0.15molH2S的气体体积为V=0.15×22.4L=3.36L;
故答案为2.24; 3.36;
(2)由阿伏伽德罗定律得![]() ,可得
,可得![]() ,带入密度之比为
,带入密度之比为![]() 中,可得密度之比等于摩尔质量之比,SO2与氦气的密度之比为64:4=16:1,若两气体质量相同,则由
中,可得密度之比等于摩尔质量之比,SO2与氦气的密度之比为64:4=16:1,若两气体质量相同,则由![]() 可得体积之比等于物质的量之比,V SO2:VHe=
可得体积之比等于物质的量之比,V SO2:VHe= ![]() :
: ![]() =1:16。若两气体体积相等,则由
=1:16。若两气体体积相等,则由![]() 可得两物质的物质的量相同,由m=nM可得质量之比等于摩尔质量之比,m1:m2=64:4=16:1;
可得两物质的物质的量相同,由m=nM可得质量之比等于摩尔质量之比,m1:m2=64:4=16:1;
故答案为16∶11∶16;16∶1;
(3)①氢气的物质的量为![]() = 2mol,其分子数为2NA,原子数为4NA,质量为4g,标准状况下的体积为2mol×22.4L/mol=44.8L;
= 2mol,其分子数为2NA,原子数为4NA,质量为4g,标准状况下的体积为2mol×22.4L/mol=44.8L;
②氧气的物质的量为![]() =0.5mol,其分子数为0.5NA,原子数为NA,质量为0.5mol×32g/mol=16g,标准状况下的体积为11.2L;
=0.5mol,其分子数为0.5NA,原子数为NA,质量为0.5mol×32g/mol=16g,标准状况下的体积为11.2L;
③水的物质的量为1mol,其分子数为NA,原子数为3NA,质量为1mol×18g/mol=18g,标准状况下水为液体,其体积在三者中最小;
显然分子数最多的是①,原子数最多的是①,质量最大的是③,体积最小的是③;
故答案为①;①;③;③。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案【题目】t ℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)![]() 2Z(g),各组分在不同时刻的浓度如下表,下列说法正确的是
2Z(g),各组分在不同时刻的浓度如下表,下列说法正确的是
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
2 min末浓度/mol·L-1 | 0.08 | a | b |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
A. 平衡时,X的转化率为20%
B. t ℃时,该反应的平衡常数为40
C. 前2 min内,用Y的变化量表示的平均反应速率v(Y)="0.03" mol·L-1·min-1
D. 增大平衡后的体系压强,v正增大,v逆减小,平衡向正反应方向移动