题目内容
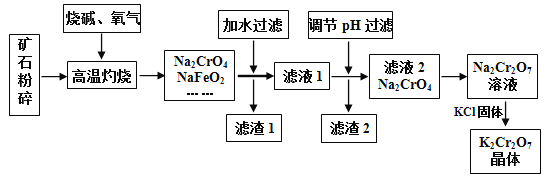
【题目】重铬酸钾(K2Cr2O7)是高中化学常见的的氧化剂,工业上以铬铁矿为原料用碱溶氧化法制备。铬铁矿中通常含有Cr2O3、FeO、Al2O3、SiO2等。
已知:
①NaFeO2常温遇大量水会强烈水解,高温时不与水反应
②2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
③+6价的铬元素在强酸性条件下具有强氧化性,还原产物为Cr3+,强碱性条件下几乎没有氧化性;请回答下列问题:
(1)将矿石粉碎的目的是___________________________。
(2)高温灼烧时生成NaFeO2的化学方程式____________________________________。
(3)①滤渣1中有红褐色物质,滤渣1的成分为__________________(写化学式,下同),写出生成该物质反应的离子方程式___________________________。
②滤渣2的主要成分是__________________。
(4)若向Na2CrO4溶液中加入浓盐酸进行酸化,出现的现象为__________________
(5)生产后的废水中主要含有一定量的Cr2O72-,通常加一定量的绿矾进行净化并调节pH约为6,可生成两种难溶于水的沉淀,请写出该反应的离子方程式___________________________。
【答案】增大接触面积,加快反应速率 4FeO + O2 + 4NaOH= 4FeO2 + 2H2O(条件高温) Fe(OH)3 FeO2- + 2H2O = Fe(OH)3+ OH- Al(OH)3 、H2SiO3 有黄绿色气体生成 Cr2O72- + 6Fe2+ + 17H2O = 2Cr(OH)3↓ + Fe(OH)3↓ + 10H+
【解析】
本题主要考查物质分离和提纯的方法和基本操作综合应用。铁矿中通常含有Cr2O3、FeO、Al2O3、SiO2等,将铬铁矿和烧碱、氧气混合焙烧得到Na2CrO4、NaFeO2,而SiO2与NaOH发生反应生成Na2SiO3,Al2O3与NaOH发生反应,生成NaAlO2,故还含有Na2SiO3、NaAlO2,由于NaFeO2会发生强烈水解,滤渣1中有红褐色物质,可推知NaFeO2水解生成氢氧化钠与氢氧化铁,过滤分离,滤液1中主要是NaAlO2、Na2SiO3、Na2CrO4、NaOH,滤渣1为Fe(OH)3;调节溶液pH,使NaAlO2、Na2SiO3反应转化为H2SiO3、Al(OH)3沉淀,过滤除去,滤液2主要是Na2CrO4,加入硫酸酸化,溶质变为Na2Cr2O7,然后加入KCl固体,利用溶解度不同或者受温度影响不同,结晶得到K2Cr2O7晶体,采用过滤方法得到K2Cr2O7晶体,据此分析作答。
(1)将矿石粉碎的目的是:增大反应物的表面积,加快反应速率;
(2)由题可知,FeO与O2、NaOH在高温灼烧的条件下生成NaFeO2,该反应中FeO被氧化,化合价升高1,O2被还原为-2价氧,根据化合价升降守恒以及原子守恒配平该化学方程式为:4FeO + O2 + 4NaOH![]() 4FeO2 + 2H2O;
4FeO2 + 2H2O;
(3)①由上述分析可知,滤渣1的成分为Fe(OH)3;由题干信息①可知,NaFeO2常温遇大量水会强烈水解,生成有红褐色Fe(OH)3沉淀,故其水解离子方程式为:FeO2-+ 2H2O = Fe(OH)3![]() + OH-;
+ OH-;
②由上述分析可知滤渣2的主要成分是Al(OH)3 、H2SiO3;
(4)Na2CrO4溶液中铬是以+6价形式存在,由题干信息③可知,若加入浓盐酸酸化,+6价铬会表现出强氧化性,而HCl中Cl-具有还原性,故加入浓盐酸后,会发生氧化还原反应生成Cl2,故实验现象是有黄绿色气体生成;
(5)生产后的废水呈强酸性,强酸性条件下的Cr2O72-具有强氧化性,绿矾中Fe2+具有还原性,故加入绿矾后发生氧化还原反应,生成Cr3+、Fe3+等,同时通过调节溶液pH,将Cr3+、Fe3+以Cr(OH)3、Fe(OH)3沉淀,从而达到净化目的,故该反应过程的离子方程式为:Cr2O72- + 6Fe2+ + 17H2O = 2Cr(OH)3↓ + Fe(OH)3↓ + 10H+。

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案【题目】1,2-二氯丙烷(CH2ClCHClCH3)是重要的化工原料,工业上可用丙烯加成法生产,主要副产物为3-氯丙烯(CH2=CHCH2C1) ,反应原理为
i.CH2=CHCH,3(g)+Cl2(g)![]() CH2ClCHClCH3(g) ΔH1= -134 kJ mol-1
CH2ClCHClCH3(g) ΔH1= -134 kJ mol-1
ii.CH2=CHCH,3(g)+Cl2(g)![]() CH2=CHCH2Cl (g)+HCl(g) ΔH2= -l02 kJ mol-1
CH2=CHCH2Cl (g)+HCl(g) ΔH2= -l02 kJ mol-1
已知:相关化学键的键能数据如下表所示:
化学键 | C=C | C—C | C—Cl | Cl—Cl |
E/( kJ mol-1) | 611 | x | 328 | 243 |
请回答下列问题:
(1)由反应i计算出表中x=_____________。
(2)一定温度下,密闭容器中发生反应i和反应ii,达到平衡后增大压强,CH2C1CHC1CH3的产率______(填“增大”“减小”或“不变”),理由是_________________________________。
(3)T1℃时,向10L恒容的密闭容器中充入1 mol CH2=CHCH2C1和2 mol HC1,只发生反应CH2=CH CH2Cl (g)+HCl(g)![]() CH2ClCHClCH3(g) ΔH3。 5min反应达到平衡,测得 05 min内,用CH2ClCHClCH3表示的反应速率 v(CH2ClCHClCH3)=0.016 mol·L-1 min-1。
CH2ClCHClCH3(g) ΔH3。 5min反应达到平衡,测得 05 min内,用CH2ClCHClCH3表示的反应速率 v(CH2ClCHClCH3)=0.016 mol·L-1 min-1。
①平衡时,HCl的体积分数为_________(保留三位有效数字)。
②保持其它条件不变,6 min时再向该容器中充入0.6 mol CH2=CHCH2Cl、0.2molHC1和0.1mol CH2ClCHClCH3,则起始反应速率 v正(HCl)___ V逆(HCl) (填“>”“<”或“=”)。
【题目】硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。有关物质的部分性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
SO2Cl2 | -54.1 | 69.1 | ①易水解,产生大量白雾 ②易分解:SO2Cl2 |
H2SO4 | 10.4 | 338 | 吸水性且不易分解 |
实验室用干燥、纯净的二氧化硫和氯气合成硫酰氯,装置如图所示(夹持仪器已省略),请回答有关问题:
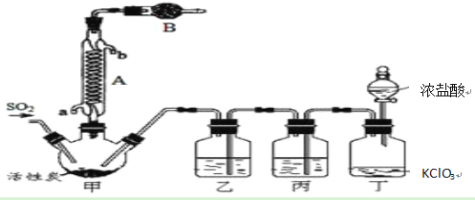
(1)仪器A冷却水的进水口为________(填“a”或“b”)。
(2)仪器B中盛放的药品是________,其目的是________________________。
(3)实验时,装置丁中发生反应的离子方程式为______________________________,当生成6.72L的氯气(标况下),转移电子的物质的量为________。
(4)装置丙中盛放的试剂是________,若缺少装置乙,对实验造成的影响是_______________。
(5)少量硫酰氯也可用液态氯磺酸(ClSO3H)低温催化分解获得,该反应的化学方程式为:2ClSO3H=H2SO4 +SO2Cl2,从分解产物中分离出硫酰氯的操作是______________。



