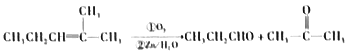题目内容
【题目】黄铜矿(CuFeS2)是炼铜的最主要矿物。火法冶炼黄铜矿的过程中,其中一步反应是: 2Cu2O+Cu2S![]() 6Cu+SO2。回答下列问题。
6Cu+SO2。回答下列问题。
(1)Cu+的价电子轨道表示式为________;Cu2O与Cu2S比较,熔点较高的是_____,原因是________。.
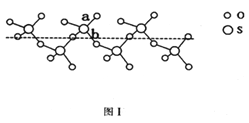
(2)SO2与SO3的健角相比,键角更大的是_____,将纯液态SO3冷却到289.8K时凝固得到一种螺旋状单链结构的固体,其结构如下图1,此固态SO3中S原子的杂化轨道类型是_________;该结构中S-O键长有两类。一类键长约140pm,另一类键长月为160pm,较短的键为_______。(填图中字母)
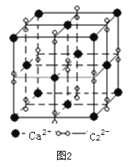
(3)离子化合物CaC2的一种晶体结构如图2所示。该物质的电子式_____。从钙离子看,属于________堆积,其配位数是_________;一个晶胞含有的π键平均有________个。
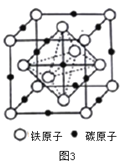
(4)奥氏体是碳溶解γ-Fe中形成的一种间隙固溶体,无磁性,其晶胞如图3所示,则该物质的化学式为________,若晶体密度为dg/cm3,则晶胞中最近的两个碳原子的距离为________pm (阿伏加德罗常数的值用NA表示,写出计算式即可)。
【答案】 ![]() Cu2O 两物质均为离子化合物,且带电荷数相同,O2-半径小于S2-,所以CuO的晶格能大,熔点更高 SO3 sp3 a
Cu2O 两物质均为离子化合物,且带电荷数相同,O2-半径小于S2-,所以CuO的晶格能大,熔点更高 SO3 sp3 a ![]() 面心立方 8 略 FeC
面心立方 8 略 FeC ![]()
【解析】(1)Cu位于第四周期IB族,Cu+的价电子为第三层的d能级,根据泡利原理和洪特规则,Cu+价电子轨道式为![]() ;Cu2O和Cu2S都属于离子晶体,晶格能越大,晶体熔沸点越高,晶格能与半径、所带电荷数有关,半径越小、所带电荷数越多,晶格能越大,Cu2O和Cu2S所带电荷数相同,S2-的半径大于O2-的半径,因此Cu2S的沸点低于Cu2O;正确答案:
;Cu2O和Cu2S都属于离子晶体,晶格能越大,晶体熔沸点越高,晶格能与半径、所带电荷数有关,半径越小、所带电荷数越多,晶格能越大,Cu2O和Cu2S所带电荷数相同,S2-的半径大于O2-的半径,因此Cu2S的沸点低于Cu2O;正确答案:![]() ;Cu2O;物质均为离子化合物,且带电荷数相同,O2-半径小于S2-,所以CuO的晶格能大,熔点更高。
;Cu2O;物质均为离子化合物,且带电荷数相同,O2-半径小于S2-,所以CuO的晶格能大,熔点更高。
(2)SO2含有的孤电子对为(6-2×2)/2=1,SO3中含有孤电子对为(6-2×3)/2=0,孤电子对之间的斥力>孤电子对-成键电子对之间的斥力>成键电子对之间斥力,因此SO3键角大于SO2键角,根据图1,S有4个σ键,无孤电子对,价层电子对数为4,杂化轨道数等于价层电子对数,即杂化类型为sp3;如图所示,a含有双键的成分,键能较大,键长较短,另一类为配位键,为单键,键能较小,键长较长,即较短的键为a; 正确答案:SO3 ; sp3 ; a。
(3)根据图2,CaC2的电子式为:![]() ;根据晶胞的结构,Ca2+位于顶点和面心,因此属于面心立方堆积;C22-位于棱上和体心,属于晶胞的C22-的个数为12×1/4+1=4,根据CaC2的电子式,两个碳原子之间有3对电子对,即1个C22-有2个π键,即1个晶胞中有2×4=8个π键;正确答案:
;根据晶胞的结构,Ca2+位于顶点和面心,因此属于面心立方堆积;C22-位于棱上和体心,属于晶胞的C22-的个数为12×1/4+1=4,根据CaC2的电子式,两个碳原子之间有3对电子对,即1个C22-有2个π键,即1个晶胞中有2×4=8个π键;正确答案:![]() ;面心立方; 8。
;面心立方; 8。
(4)根据图3,铁原子位于顶点、面心,个数为8×1/8+6×1/2=4,碳原子位于棱上和体心,个数为12×1/4+1=4,因此化学式为FeC,晶胞的质量为4×68/NAg,根据密度的定义,得出晶胞的边长为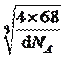 cm,根据晶胞的结构,两个最近的碳原子的距离是面对角线的一半,则两个最近的碳原子的距离是
cm,根据晶胞的结构,两个最近的碳原子的距离是面对角线的一半,则两个最近的碳原子的距离是![]() pm;正确答案:FeC ;
pm;正确答案:FeC ; ![]() 。
。

 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
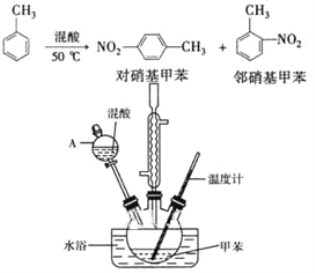
黄冈创优卷系列答案【题目】常见的一硝基甲苯有对硝基甲苯和邻硝基甲苯两种,均可用于合成各种染料。某探究小组利用下列反应和装置制备一硝基甲苯。
实验中可能用到的数据:
密度/g·cm-3 | 沸点/℃ | 溶解性 | |
甲苯 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |
实验步骤:①按体积比1:3配制浓硫酸与浓硝酸混合物40 mL;
②在三颈瓶中加入15 mL(13g)甲苯,按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸,并不断搅拌(磁力搅拌器已略去);
④控制温度约为50℃,反应大约10 min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯的总质量13.60 g。
请回答下列问题:
(1)配制混酸的方法是_______________________。反应中需不断搅拌,目的是__________________________________________。
(2)仪器A的名称是______,使用该仪器前必须进行的操作是____。
(3)若实验后在三颈瓶中收集到的产物较少,可能的原因是_____。
(4)分离反应后产物的方案如下:

其中,操作1的名称为______,操作2中需要使用下列仪器中的____(填序号)。
a.冷凝管 b.酒精灯 c.温度计 d.分液漏斗 e.蒸发皿
(5)该实验中一硝基甲苯的产率为______(保留4位有效数字)。