��Ŀ����
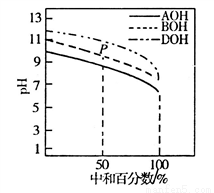
һ���¶��£���2L���ܱ������з�����Ӧ��xA(g)+B(g) 2C(g) ��H<0��A��C�����ʵ�����ʱ��仯�Ĺ�ϵ���ұ���ʾ�������й�˵����ȷ����
2C(g) ��H<0��A��C�����ʵ�����ʱ��仯�Ĺ�ϵ���ұ���ʾ�������й�˵����ȷ����
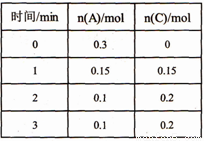
A. x=1
B. ��Ӧ��ʼ2min�ڣ���B��ʾ�ķ�Ӧ����Ϊ0.05mol �� L-l �� min -1
C. ��Ӧ���е�lminʱ����Ӧ��ϵ�ﵽ��ѧƽ��״̬
D. A������Ӧ���ʵ���C���淴Ӧ����ʱ����Ӧ��ϵ�ﵽ��ѧƽ��״̬
�¹���ѧ�ҹ���(F. Haber, 1868-1930)�����ĺϳɰ�����ʹ�����еĵ���������������ʵ������ݽߵ�������Դ���Ӷ�ʹũҵ�������������ij̶ȼ���������˵���������ʳ���㵼�µļ������������⡣�����λ���������ʳΣ���Ļ�ѧ��Ż����1918��ŵ������ѧ��������������ʵ����ģ�ҵ�ư��Ĺ��̣���̽�����������ƽ���Ӱ�졣
�������ϣ�������¼������ݣ�
��ѧ�� | N��N | H-H | N-H |
����/(kJ/mol) | 946 | 436 | 391 |
(1)���㹤ҵ�ϳɰ���Ӧ�ķ�Ӧ�ȣ�N2(g)+3H2(g)  2NH3(g) ��H=________ kJ/mol
2NH3(g) ��H=________ kJ/mol
(2)һ���¶��£���һ����ѹ�����г���N20.6mol��H2 0 .5mol����һ���¶��½��з�Ӧ��N2(g)+3H2(g)  2NH3(g)���ﵽƽ��ʱ��N2��ת����Ϊ1/6����ʱ���������Ϊ1L��
2NH3(g)���ﵽƽ��ʱ��N2��ת����Ϊ1/6����ʱ���������Ϊ1L��
�ٸ��¶�ʱ������ƽ����ϵ��ƽ�ⳣ����______________��
��������ƽ��ʱ���¶Ⱥ�ѹǿ���䣬������ƽ����ϵ��ͨ��0.9mol N2����ƽ�⽫_______(�������������)�ƶ���
(3)������ѹǿ��ȣ��¶ȷֱ�ΪT1��T2�������г�����1 mol N2��3 molH2��ɵĻ�����壬������ӦN2(g)+3H2(g)  2NH3(g)��ƽ���ı���������������� N2�����������ѹǿ�ı仯��ͼ��ʾ����ͼ�ж�����˵����ȷ����______________
2NH3(g)��ƽ���ı���������������� N2�����������ѹǿ�ı仯��ͼ��ʾ����ͼ�ж�����˵����ȷ����______________

a.A�� B�� C�����ƽ�ⳣ����С��ϵ��KA<KB<KC
b.B���C���H2Ũ�ȴ�С��ϵ��B<C
c.A���B����������ܶȴ�С��ϵ��A<B
d.A���C���������ƽ����Է���������С��ϵ��A>C
(4)�ϳɰ���ҵ���������������CO2����ҵ�ϳ��ø�Ũ�ȵ�K2CO3��Һ����CO2��,����ҺX�������õ�ⷨK2CO3��Һ��������װ����ͼ��ʾ��
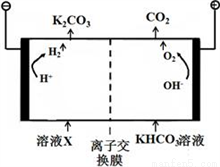
���������������ķ�Ӧ����____________________��H++ HCO3-=H2O+CO2����
�ڼ���CO32-��������������ԭ��________________��
������װ���в�����CO2��H2��һ�������·�Ӧ���ɼ״�����ҵ�����ø÷�Ӧ�ϳɼ״���
��֪��25 �棬101 KPa�£�
2H2(g)+ O2(g)=2H2O(g) �� H1=-484kJ/mol
2CH3OH(g)+3 O2(g)=2CO2 (g)+4H2O(g) �� H2=-1352kJ/mol
д��CO2��H2����1molCH3OH(g)���Ȼ�ѧ����ʽ_______________��





 Na++ OH-
Na++ OH-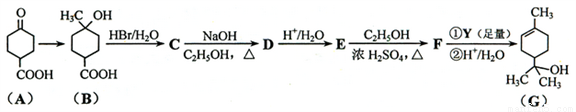

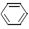 + H2(g) ��
+ H2(g) �� 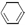 (l) ��H��0 �٣�
(l) ��H��0 �٣� 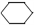 (l) ��H��0 �ڡ�
(l) ��H��0 �ڡ�