题目内容
已知两个热化学方程式如下:
(l) 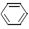 + H2(g) →
+ H2(g) → 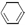 (l) △H>0 ①;
(l) △H>0 ①;
(l)  + 2H2(g) →
+ 2H2(g) → 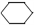 (l) △H<0 ②。
(l) △H<0 ②。
则下列有关说法不正确的是( )
A. 反应①、②的热效应说明苯环中含有的并不是碳碳双键
B. 反应①、②都属于加成反应
C. 苯 比1,3一环己二烯更稳定
D. 反应①、②中的所有有机物均可使溴水层褪色,且褪色原理也完全相同
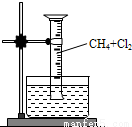
某校化学课外学习小组发现将镁粉按图投入纯水中现象不明显,而投入氯化铵溶液中,两者立即发生反应,产生大量气泡。经检验该过程产生两种气体,其中一种气体有刺激性气味。
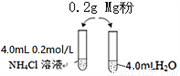
(1)实验开始时用校准过的pH传感器测定纯水的pH,发现纯水的pH总是在7.30左右,其原因可能是_____________________
(2)请设计简单的实验方案检验上述实验中有刺激性气味的气体:__________________
(3)实验中0.2mol/L氯化铵溶液的pH为5.90,请用离子方程式解释原因:_________________
(4)该小组同学为探究镁与氯化铵溶液反应的原因设计了如下实验方案:
序号 | 实验试剂 | 实验现象 | |
实验1-1 | 0.20g镁粉 | 3.0mL 0.2mol/LNH4Cl溶液 | 反应明显,有气泡产生 |
实验1-2 | 0.20g镁粉 | 3.0mL盐酸 | 反应不明显,几乎没有气泡产生 |
①上述探究实验1-2选用的盐酸为_____________(填字母)。
A、1 mol·L-1 B、pH=1.0 C、0.2 mol·L-1 D、pH=5.90
②通过实验对比,说明NH4Cl 水解产生的H+ 对反应影响_____NH4+ 对反应影响(填“小于”、“大于”或“等于”)。
(5)该小组同学继续探究镁粉与氯化铵溶液反应剧烈的影响因素。
实验序号 | 实验试剂 | |
实验2-1 | 0.20g镁粉 | ________________ |
实验2-2 | 0.20g镁粉 | _________________ |
实验3-1 | 0.20g镁粉 | 3.0mL0.2mol/L NH4NO3溶液 |
实验3-2 | 0.20g镁粉 | 3.0mL0.2mol/L KNO3溶液 |
①实验2-1与实验2-2中实验现象说明Cl-对反应速率的影响很小,请补充完成实验方案所需的试剂。
②实验3-1与实验3-2的结论说明NH4+对反应速率影响很大,则两支试管中实验现象的不同之处是___________________
(6)写出镁与氯化铵溶液反应生成Mg2+的离子方程式_______________。


 2C(g) △H<0,A、C的物质的量随时间变化的关系如右表所示。下列有关说法正确的是
2C(g) △H<0,A、C的物质的量随时间变化的关系如右表所示。下列有关说法正确的是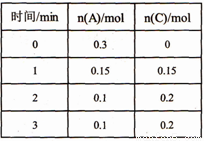
 ),下列有关联苯的说法中正确的是( )
),下列有关联苯的说法中正确的是( )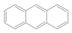 )同属于芳香烃,两者互为同系物
)同属于芳香烃,两者互为同系物 ,它主要用于棉纤维织物的染色,也用于制一些有机颜料,若分子式与红色基B相同,且氨基(一NH2)与硝基(一NO2)直接连在苯环上并呈对位时的同分异构体数目(包括红色基B)为
,它主要用于棉纤维织物的染色,也用于制一些有机颜料,若分子式与红色基B相同,且氨基(一NH2)与硝基(一NO2)直接连在苯环上并呈对位时的同分异构体数目(包括红色基B)为