题目内容
20.甘氨酸和丙氨酸以1:1的配比两两缩合后,得到的产物可能是( )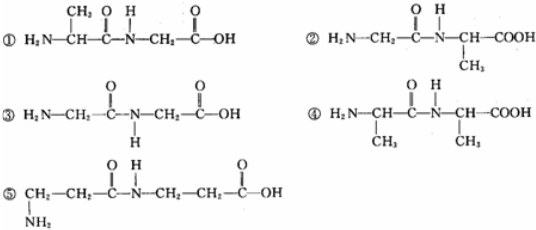
| A. | ①② | B. | ①②③ | C. | ①②③④ | D. | ①②③④⑤ |
分析 甘氨酸和丙氨酸以1:1的配比两两缩合后,可能是丙氨酸中羧基和甘氨酸中的氨基发生缩合、可能是甘氨酸中的羧基和丙氨酸中的氨基缩合、可能是甘氨酸中羧基和甘氨酸中氨基缩合、可能是丙氨酸中羧基和丙氨酸中氨基发生缩合,据此分析解答.
解答 解:甘氨酸和丙氨酸以1:1的配比两两缩合后,可能是丙氨酸中羧基和甘氨酸中的氨基发生缩合、可能是甘氨酸中的羧基和丙氨酸中的氨基缩合、可能是甘氨酸中羧基和甘氨酸中氨基缩合、可能是丙氨酸中羧基和丙氨酸中氨基发生缩合,所以得到的结构简式可能是①②③④,故选C.
点评 本题考查氨基酸的缩合反应,为高频考点,明确官能团及其性质关系是解本题关键,注意:同种氨基酸也能发生缩合反应,为易错点.

练习册系列答案
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案
相关题目
10.下列有关化学用语使用正确的是( )
| A. | 硫离子(S2?)结构示意图: | |
| B. | NH4Cl的电子式: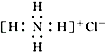 | |
| C. | 原子核内有8个质子、10个中子的氧原子:${\;}_{8}^{10}$O | |
| D. | H、D、T互为同素异形体 |
8.下列化学用语表示正确的是( )
| A. | N2分子的电子式: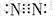 | B. | 中子数为18的氯原子的原子符号: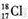 | ||
| C. | 18O2-的结构示意图: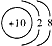 | D. | CO2的比例模型: |
15.下列各项叙述中一定能说明元素X的非金属性比元素Y的非金属性强的是( )
| A. | X原子在反应中得到的电子数比Y原子在反应中得到的电子数少 | |
| B. | 气态氢化物 Y比X稳定 | |
| C. | X的最高正价比Y的最高正价高 | |
| D. | X单质能与Y的氢化物反应生成Y单质 |
5.分子式为C3H6O且能使溴水褪色的有机物有( )种.
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
18.能正确表示下列反应的离子方程式是( )
| A. | 将氯气通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| B. | Ca(HCO3)2溶液与少量的NaOH溶液混合2HCO3-+Ca2++2OH-═2 H2O+CaCO3↓+CO32- | |
| C. | 磁性氧化铁溶液与稀硝酸:3Fe3O4+28H++NO3-═9Fe3++NO↑+14H2O | |
| D. | NH4HCO3溶液与过量的NaOH溶液混合共热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O |

 ;
; 、-CHO;③的反应类型为加成反应(或还原反应).
、-CHO;③的反应类型为加成反应(或还原反应). .
.
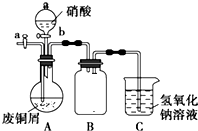 碱式碳酸铜是一种化工原料,化学式用mCu(OH)2•nCuCO3表示.实验室以废铜屑为原料制取碱式碳酸铜的步骤如图:
碱式碳酸铜是一种化工原料,化学式用mCu(OH)2•nCuCO3表示.实验室以废铜屑为原料制取碱式碳酸铜的步骤如图: