题目内容
在容器体积可变的密闭容器中,反应N2(g)+3H2(g)?2NH3(g)在一定条件下达到平衡.
完成下列填空:
(1)若该反应经过2秒钟后达到平衡,NH3的浓度增加了0.6mol/L,在此期间,正反应速率v(H2)的值为______
A.0.6mol/(L?s) B.0.45mol/(L?s)
C.0.3mol/(L?s) D.0.2mol/(L?s)
(2)在其他条件不变的情况下,缩小容器体积以增大反应体系的压强,v正______(选填“增大”、“减小”,下同),v逆______,平衡向______方向移动(选填“正反应”、“逆反应”).
(3)在其他条件不变的情况下,降低温度平衡向正反应方向移动,则正反应为______反应(选填“吸热”、“放热”).
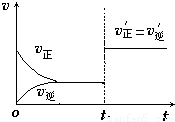
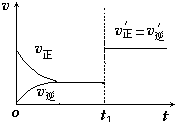
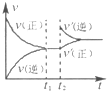
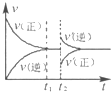
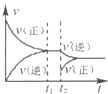
(4)如图为反应速率(ν)与时间(t)关系的示意图,由图判断,在t1时刻曲线发生变化的原因是______(填写编号).
a.增大N2的浓度 b.扩大容器体积 c.加入催化剂 d.升高温度
改变条件后,平衡混合物中NH3的百分含量______(选填“增大”、“减小”、“不变”).
(5)若达到平衡时,n(N2):n(H2):n(NH3)=2:2:1.保持温度不变,以2:2:1的物质的量之比再充入N2、H2、NH3,则______
A.平衡向正反应方向移动 B.平衡不移动
C.平衡时,NH3的体积分数增大 D.平衡时,NH3的体积分数可能减小.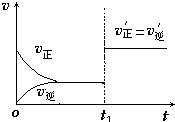
完成下列填空:
(1)若该反应经过2秒钟后达到平衡,NH3的浓度增加了0.6mol/L,在此期间,正反应速率v(H2)的值为______
A.0.6mol/(L?s) B.0.45mol/(L?s)
C.0.3mol/(L?s) D.0.2mol/(L?s)
(2)在其他条件不变的情况下,缩小容器体积以增大反应体系的压强,v正______(选填“增大”、“减小”,下同),v逆______,平衡向______方向移动(选填“正反应”、“逆反应”).
(3)在其他条件不变的情况下,降低温度平衡向正反应方向移动,则正反应为______反应(选填“吸热”、“放热”).
(4)如图为反应速率(ν)与时间(t)关系的示意图,由图判断,在t1时刻曲线发生变化的原因是______(填写编号).
a.增大N2的浓度 b.扩大容器体积 c.加入催化剂 d.升高温度
改变条件后,平衡混合物中NH3的百分含量______(选填“增大”、“减小”、“不变”).
(5)若达到平衡时,n(N2):n(H2):n(NH3)=2:2:1.保持温度不变,以2:2:1的物质的量之比再充入N2、H2、NH3,则______
A.平衡向正反应方向移动 B.平衡不移动
C.平衡时,NH3的体积分数增大 D.平衡时,NH3的体积分数可能减小.

(1)2秒钟后达到平衡,NH3的浓度增加了0.6mol/L,v(NH3)=
=0.3mol/(L?s),由反应速率之比等于化学计量数之比可知v(H2)=0.3mol/(L?s)×
=0.45mol/(L?s),故答案为:B;
(2)增大反应体系的压强,正逆反应速率均增大,但该反应为气体体积缩小的反应,增大压强向气体体积缩小的方向移动,则平衡向正反应方向移动,
故答案为:增大;增大;正反应;
(3)降低温度平衡向正反应方向移动,所以正反应为放热反应,故答案为:放热;
(4)t1时刻,正逆反应速率同等程度的增大,则改变的条件为催化剂,催化剂对化学平衡无影响,则平衡混合物中NH3的百分含量不变,
故答案为:c;不变;
(5)达到平衡时,n(N2):n(H2):n(NH3)=2:2:1.保持温度不变,以2:2:1的物质的量之比再充入N2、H2、NH3,由pV=nRT可知,各物质的浓度不变,所以化学平衡不移动,NH3的体积分数不变,故答案为:B.
| 0.6mol/L |
| 2 |
| 3 |
| 2 |
(2)增大反应体系的压强,正逆反应速率均增大,但该反应为气体体积缩小的反应,增大压强向气体体积缩小的方向移动,则平衡向正反应方向移动,
故答案为:增大;增大;正反应;
(3)降低温度平衡向正反应方向移动,所以正反应为放热反应,故答案为:放热;
(4)t1时刻,正逆反应速率同等程度的增大,则改变的条件为催化剂,催化剂对化学平衡无影响,则平衡混合物中NH3的百分含量不变,
故答案为:c;不变;
(5)达到平衡时,n(N2):n(H2):n(NH3)=2:2:1.保持温度不变,以2:2:1的物质的量之比再充入N2、H2、NH3,由pV=nRT可知,各物质的浓度不变,所以化学平衡不移动,NH3的体积分数不变,故答案为:B.

练习册系列答案
相关题目
 在容器体积可变的密闭容器中,反应N2(g)+3H2(g)?2NH3(g)在一定条件下达到平衡.
在容器体积可变的密闭容器中,反应N2(g)+3H2(g)?2NH3(g)在一定条件下达到平衡.
 (3)在其他条件不变的情况下,降低温度平衡向正反应方向移动,则正反应为 反应(选填“吸热”、“放热”)。
(3)在其他条件不变的情况下,降低温度平衡向正反应方向移动,则正反应为 反应(选填“吸热”、“放热”)。