��Ŀ����
����������ɱ���ܱ������У���ӦN2(g)![]() 3H2(g)
3H2(g) ![]() 2NH3(g)��һ�������´ﵽƽ�⡣���������գ�
2NH3(g)��һ�������´ﵽƽ�⡣���������գ�
��1�����÷�Ӧ����2���Ӻ�ﵽƽ�⣬NH3��Ũ��������0.6mol/L���ڴ��ڼ䣬����Ӧ����![]() (H2)��ֵΪ
(H2)��ֵΪ
A��0.6mol/(L��s) B��0.45 mol/(L��s) C��0.3 mol/(L��s) D��0.2 mol/(L��s)
��2���������������������£���С�������������Ӧ��ϵ��ѹǿ��v���� ������ѡ���������С������ͬ����v������ ����ƽ������ ���������ƶ���ѡ�����Ӧ�������淴Ӧ������
 ��3���������������������£������¶�ƽ��������Ӧ�����ƶ���������ӦΪ����������Ӧ��ѡ����ȡ��������ȡ�����
��3���������������������£������¶�ƽ��������Ӧ�����ƶ���������ӦΪ����������Ӧ��ѡ����ȡ��������ȡ�����
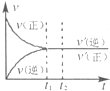
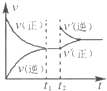
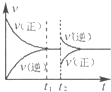
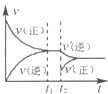
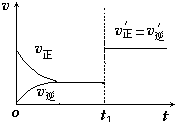
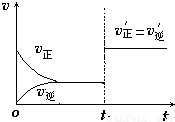
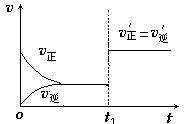
��4����ͼΪ��Ӧ���ʣ�������ʱ�䣨t����ϵ��ʾ��ͼ����ͼ�жϣ���t1ʱ�����߷����仯��ԭ��������������д��ţ���
a������N2��Ũ�� b�������������
c��������� d�������¶�
�ı�������ƽ��������NH3�İٷֺ����� ������ѡ���������С���������䡱����
��5�����ﵽƽ��ʱ��n(N2)��n(H2)��n(NH3)![]() �������¶Ȳ��䣬��
�������¶Ȳ��䣬��![]() �����ʵ���֮���ٳ���N2��H2��NH3����
�����ʵ���֮���ٳ���N2��H2��NH3����
A��ƽ��������Ӧ�����ƶ� B��ƽ�ⲻ�ƶ�
C��ƽ��ʱ��NH3������������� D��ƽ��ʱ��NH3������������ܼ�С
(1)B (2��) (2) ������������Ӧ��ÿ��1�֣�
(3) ���ȣ�1�֣� (4) C��1�֣������䣨1�֣� (5)B ��2�֣�

 ��ĩ�óɼ�ϵ�д�
��ĩ�óɼ�ϵ�д� 99��1������ĩ��ѵ��ϵ�д�
99��1������ĩ��ѵ��ϵ�д� ��ǿ��У��ĩ���100��ϵ�д�
��ǿ��У��ĩ���100��ϵ�д� �óɼ�1��1��ĩ���100��ϵ�д�
�óɼ�1��1��ĩ���100��ϵ�д� ��״Ԫ���źþ�ϵ�д�
��״Ԫ���źþ�ϵ�д�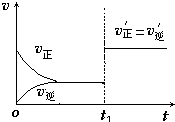 ����������ɱ���ܱ������У���ӦN2��g��+3H2��g��?2NH3��g����һ�������´ﵽƽ�⣮
����������ɱ���ܱ������У���ӦN2��g��+3H2��g��?2NH3��g����һ�������´ﵽƽ�⣮