题目内容
(2010?临沂一模)A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A是周期表中原子半径最小的元素;B元素的最高价氧化物的水化物与其氢化物能相互反应生成盐;A元素与C元素可形成两种液态化合物,其原子个数比分别为1:1和2:1,分子中电子总数分别为18和10;D元素的主族序数等于其周期数;E元素原子的最外层电子数是其电子层数的2倍.
(1)写出D元素的原子结构示意图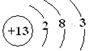
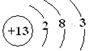 ;E元素在周期表中位置
;E元素在周期表中位置
(2)C和E两种元素相比较,非金属性较强的是(填元素符号)
A.比较这两种元素的常见单质的沸点 B.比较这两种元素的单质与氢气化合的难易 C.比较这两种元素的气态氢化物的稳定性
(3)写出D的氢氧化物在水中发生酸式电离的电离方程式:
(4)B元素与C元素形成的化合物中,其中甲的相对分子质量最小.在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的B的含氧酸盐的化学式是
(1)写出D元素的原子结构示意图
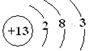
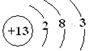
第三周期第VIA族
第三周期第VIA族
;(2)C和E两种元素相比较,非金属性较强的是(填元素符号)
O
O
,可以验证该结论的是BC
BC
;(填写编号)A.比较这两种元素的常见单质的沸点 B.比较这两种元素的单质与氢气化合的难易 C.比较这两种元素的气态氢化物的稳定性
(3)写出D的氢氧化物在水中发生酸式电离的电离方程式:
Al(OH)3 AlO2-+H++H2O
AlO2-+H++H2O
 AlO2-+H++H2O
AlO2-+H++H2OAl(OH)3 AlO2-+H++H2O
AlO2-+H++H2O
,欲使上述体系中D的简单阳离子浓度增加,可加入的物质是 AlO2-+H++H2O
AlO2-+H++H2O盐酸(稀硫酸也可以)
盐酸(稀硫酸也可以)
;(4)B元素与C元素形成的化合物中,其中甲的相对分子质量最小.在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的B的含氧酸盐的化学式是
NaNO2
NaNO2
.分析:A是周期表中原子半径最小的元素,应为H元素;B元素的最高价氧化物的水化物与其氢化物能相互反应生成盐,应为N元素;A元素与C元素可形成两种液态化合物,其原子个数比分别为1:1和2:1,则C为O元素,形成的化合物为H2O2和H2O,分子中电子总数分别为18和10;D元素的主族序数等于其周期数,应为Al元素;E元素原子的最外层电子数是其电子层数的2倍,应为S元素,结合元素对应单质、化合物的性质以及在周期表中的位置解答该题.
解答:解:A是周期表中原子半径最小的元素,应为H元素;B元素的最高价氧化物的水化物与其氢化物能相互反应生成盐,应为N元素;A元素与C元素可形成两种液态化合物,其原子个数比分别为1:1和2:1,则C为O元素,形成的化合物为H2O2和H2O,分子中电子总数分别为18和10;D元素的主族序数等于其周期数,应为Al元素;E元素原子的最外层电子数是其电子层数的2倍,应为S元素,则
(1)D为Al元素,原子序数为13,原子核外有3个电子层,最外层电子数位3,则原子结构示意图为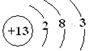 ,E为S元素,原子序数为16,核外有3个电子层,最外层电子数为6,应位于周期表第三周期第VIA族,
,E为S元素,原子序数为16,核外有3个电子层,最外层电子数为6,应位于周期表第三周期第VIA族,
故答案为: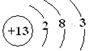 ; 第三周期第VIA族;
; 第三周期第VIA族;
(2)C为O元素,E为S元素,二者处于同一主族,根据同主族元素从上到下,元素的非金属性逐渐减弱,则O的非金属性大于S,比较元素的非金属性强弱,可根据氢化物的稳定性,两种元素的单质与氢气化合的难易比较,
故答案为:O;BC;
(3)Al(OH)3为两性氢氧化物,酸式电离为Al(OH)3 AlO2-+H++H2O,
AlO2-+H++H2O,
碱式电离为Al(OH)3 Al3++3OH-,要使溶液中Al3+浓度增加,应加入酸,使碱式电离平衡向正反应方向移动,
Al3++3OH-,要使溶液中Al3+浓度增加,应加入酸,使碱式电离平衡向正反应方向移动,
故答案为:Al(OH)3 AlO2-+H++H2O;盐酸(稀硫酸也可以);
AlO2-+H++H2O;盐酸(稀硫酸也可以);
(4)N元素与O元素形成的化合物中相对分子质量最小的是NO,与氧气按物质的量之比为4:1反应,发生反应为4NO+O2+4NaOH=4NaNO2+2H2O,
故答案为:NaNO2.
(1)D为Al元素,原子序数为13,原子核外有3个电子层,最外层电子数位3,则原子结构示意图为
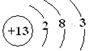 ,E为S元素,原子序数为16,核外有3个电子层,最外层电子数为6,应位于周期表第三周期第VIA族,
,E为S元素,原子序数为16,核外有3个电子层,最外层电子数为6,应位于周期表第三周期第VIA族,故答案为:
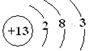 ; 第三周期第VIA族;
; 第三周期第VIA族;(2)C为O元素,E为S元素,二者处于同一主族,根据同主族元素从上到下,元素的非金属性逐渐减弱,则O的非金属性大于S,比较元素的非金属性强弱,可根据氢化物的稳定性,两种元素的单质与氢气化合的难易比较,
故答案为:O;BC;
(3)Al(OH)3为两性氢氧化物,酸式电离为Al(OH)3
 AlO2-+H++H2O,
AlO2-+H++H2O,碱式电离为Al(OH)3
 Al3++3OH-,要使溶液中Al3+浓度增加,应加入酸,使碱式电离平衡向正反应方向移动,
Al3++3OH-,要使溶液中Al3+浓度增加,应加入酸,使碱式电离平衡向正反应方向移动,故答案为:Al(OH)3
 AlO2-+H++H2O;盐酸(稀硫酸也可以);
AlO2-+H++H2O;盐酸(稀硫酸也可以);(4)N元素与O元素形成的化合物中相对分子质量最小的是NO,与氧气按物质的量之比为4:1反应,发生反应为4NO+O2+4NaOH=4NaNO2+2H2O,
故答案为:NaNO2.
点评:本题考查元素的位置结构性质的相互关系及应用,题目难度中等,本题注意强氧化铝两性的性质.

练习册系列答案
相关题目
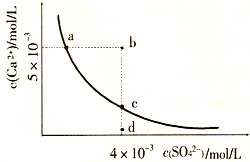 (2010?临沂一模)常温下,Ksp(CaS04)=9×l0-6,常温下CaS04在水中的沉淀溶解平衡曲线如图.下列说法正确的是( )
(2010?临沂一模)常温下,Ksp(CaS04)=9×l0-6,常温下CaS04在水中的沉淀溶解平衡曲线如图.下列说法正确的是( )
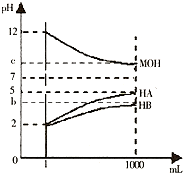 (2010?临沂一模)某化学学习小组为研究HA、HB和MOH的酸碱性的相对强弱,设计以下实验以下实验:将pH═2的两种酸溶液HA,HB和pH=12的MOH碱溶液各1mL,分别加水稀释到1000mL,其pH的变化与溶液体积的关系如图,根据所给的数据,请回答下列问题:
(2010?临沂一模)某化学学习小组为研究HA、HB和MOH的酸碱性的相对强弱,设计以下实验以下实验:将pH═2的两种酸溶液HA,HB和pH=12的MOH碱溶液各1mL,分别加水稀释到1000mL,其pH的变化与溶液体积的关系如图,根据所给的数据,请回答下列问题: