题目内容
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+ 2N2(g) 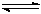 Si3N4(s) + 6CO(g)
Si3N4(s) + 6CO(g)
(1)该反应的氧化剂是 ,2molN2参加反应转移电子数为 ;
(2)该反应的平衡常数表达式为K= ;
(3)若CO的生成速率为v(CO)=18mol·L-1·min-1,则N2的消耗速率为v(N2)=
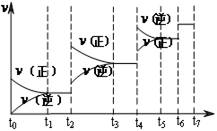
(4)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率v与时间t的关系如图。图中t4时引起平衡移动的条件可能是 ;图中表示平衡混合物中CO的含量最高的一段时间是 。
(5)若该反应的平衡常数为 K=729,则在同温度下1L密闭容器中,足量的SiO2和C与2mol N2充分反应,则N2的转化率是 (提示:272 = 729)
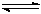 Si3N4(s) + 6CO(g)
Si3N4(s) + 6CO(g)(1)该反应的氧化剂是 ,2molN2参加反应转移电子数为 ;
(2)该反应的平衡常数表达式为K= ;
(3)若CO的生成速率为v(CO)=18mol·L-1·min-1,则N2的消耗速率为v(N2)=
(4)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率v与时间t的关系如图。图中t4时引起平衡移动的条件可能是 ;图中表示平衡混合物中CO的含量最高的一段时间是 。

(5)若该反应的平衡常数为 K=729,则在同温度下1L密闭容器中,足量的SiO2和C与2mol N2充分反应,则N2的转化率是 (提示:272 = 729)
(1)氮气 (1分) 12NA (1分)(2)K=[c(CO)]6/[c(N2)]2 (2分)(3)6 mol?L-1?min-1 (1分) (4)升高温度或增大压强(2分) t3~t4(2分) (5)50%(2分)
试题分析:(1)反应中N元素的化合价降低,有0价降为-3价,则氧化剂为氮气,氧化剂对应的生成物为还原产物,应为氮化硅,故答案为:氮气;氮化硅;(2)平衡常数等于气体生成物的浓度幂之积除以气体反应物的浓度幂之积,则K=[c(CO)]6/[c(N2)]2(3)反应放热,△H<0,升高温度平衡移动逆反应方向移动,平衡常数减小,速率之比等于化学计量数之比,则v(N2)=1/3×v(CO)=1/3×18mol?L-1?min?1="6" mol?L-1?min?1(4) t4时正逆反应速率都较原平衡时的速率大,可升高温度或增大压强,在t4时反应向逆反应方向移动,则t3~t4时平衡混合物中CO的含量最高,故答案为:升高温度或增大压强,t3~t4;
(5)设反应的N2的物质的量为x,
3SiO2(s)+6C(s)+2N2(g)
 Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)起始: 2mol 0
转化: x 3x
平衡: 2-x 3x
则平衡时N2的浓度为(2-x)mol/L,CO的浓度为3x mol/L,则有:(3x)6/(2-x)2=729,解之得x=1,则N2的转化率是50%。

练习册系列答案
相关题目
 FeO(s)+CO(g),700 ℃时平衡常数为1. 47,900 ℃时平衡常数为2.15。下列说法正确的是( )
FeO(s)+CO(g),700 ℃时平衡常数为1. 47,900 ℃时平衡常数为2.15。下列说法正确的是( )
 2NH3(g) +92.4 kJ。恒容时,体系中各物质浓度随时间变化的曲线如图示。下列说法错误的是
2NH3(g) +92.4 kJ。恒容时,体系中各物质浓度随时间变化的曲线如图示。下列说法错误的是
 2Z(g),各组分在不同时刻的浓度如下表:
2Z(g),各组分在不同时刻的浓度如下表: 2C(g)+ D(s) ,5 min后达到平衡。平衡时A为1.6mol,放出的热量为Q。在t0时刻,若从平衡体系中分离出四分之一的混合气体,新平衡体系中c(A)为0.6mol/L。
2C(g)+ D(s) ,5 min后达到平衡。平衡时A为1.6mol,放出的热量为Q。在t0时刻,若从平衡体系中分离出四分之一的混合气体,新平衡体系中c(A)为0.6mol/L。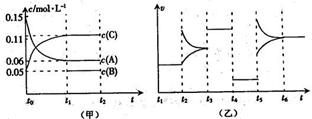
 A.反应的方程式为3A(g)+B(g) 2C(g)
A.反应的方程式为3A(g)+B(g) 2C(g)  CO2(g)十H2 (g) △H<0 , CO和H2O浓度变化如下图,
CO2(g)十H2 (g) △H<0 , CO和H2O浓度变化如下图,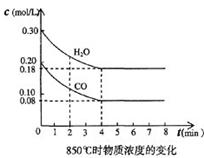
 2 C(g)反应的平衡常数和温度的关系如下:
2 C(g)反应的平衡常数和温度的关系如下: