题目内容
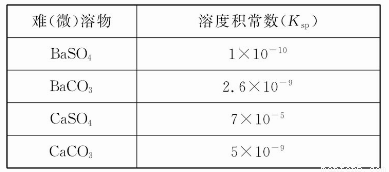
弱电解质电离情况可以用电离度和电离平衡常数表示,表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp)。
表1

表2
请回答下面问题:
(1)CH3COONH4的水溶液呈 (选填“酸性”、“中性”或“碱性”),理由是 。溶液中各离子浓度大小关系是 。
(2)物质的量之比为1∶1的NaCN和HCN的混合溶液,其pH>7,该溶液中离子浓度从大到小的排列为 。
(1)中性 CH3COONH4溶于水后,根据表1中的电离平衡常数,CH3COO-结合H+和NH4+ 结合OH-生成弱电解质的程度一样,导致水溶液中的H+和OH-浓度相等,溶液呈中性 c(NH4+)=c(CH3COO-) >c(OH-)= c(H+)
(2)c(Na+)>c(CN-)>c(OH-)>c(H+)
【解析】由于醋酸与NH3· H2O的电离平衡常数相同,故NH4+、CH3COO-水解能力相同,CH3COONH4溶液呈中性,溶液中c(CH3COO-)=c(NH4+)>c(H+)=c(OH-)。NaCN和HCN混合溶液的pH>7,说明CN-的水解能力大于HCN的电离能力,故有c(Na+)> c(CN-)>c(OH-)>c(H+)

练习册系列答案
相关题目