题目内容
7.设NA为阿伏伽德罗常数的值,下列说法中,错误的是( )| A. | 1mol${\;}_{8}^{16}$OD- 中含有的质子数、中子数均为9NA | |
| B. | 3.6 g石墨和C60的混合物中,含有的碳原子数为0.3NA | |
| C. | 反应3H2(g)+N2(g)?2NH3(g)△H=-92kJ/mol放出热量9.2kJ时,转移电子0.6NA | |
| D. | 标准状况下,4.48L戊烷含有的分子数为0.2NA |
分析 A.${\;}_{8}^{16}$OD-中含有的质子数为9、中子数为9,1mol该离子中含有的质子和中子都是9mol;
B.石墨和C60中都只含有碳原子,3.6g混合物中含有3.6g碳,含有0.3mol碳原子;
C.根据反应热计算出消耗氢气的物质的量,再计算出转移电子数;
D.标准状况下,戊烷的状态不是气体,不能使用标况下的气体摩尔体积计算.
解答 解:A.1mol${\;}_{8}^{16}$OD-中含有9mol中子和9mol中子,含有的质子数、中子数均为9NA,故A正确;
B.3.6 g石墨和C60的混合物中含有3.6g碳,含有碳原子的物质的量为:$\frac{3.6g}{12g/mol}$=0.3mol,含有的碳原子数为0.3NA,故B正确;
C.反应3H2(g)+N2(g)?2NH3(g)△H=-92kJ/mol放出热量9.2kJ时,消耗氢气的物质的量为:$\frac{9.2kJ}{92kJ/mol}$×3=0.3mol,转移的电子为:0.3mol×2=0.6mol,转移电子数为0.6NA,故C正确;
D.标况下戊烷不是气体,不能使用标况下的气体摩尔体积计算4.48L戊烷的物质的量,故D错误;
故选D.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,注意明确标况下气体摩尔体积的使用条件,熟练掌握以物质的量为中心的各化学量与阿伏加德罗常数的关系,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
18.下列与有机物的结构、性质有关的叙述正确的是( )
| A. | 苯、油脂均不能使酸性KMnO4溶液褪色 | |
| B. | 淀粉、纤维素、油脂和蛋白质均是高分子化合物 | |
| C. | 乙酸和乙醛可用新制的Cu(OH)2悬浊液加以区别 | |
| D. | 乙醇、乙酸能与Na反应放出H2,二者分子中官能团相同 |
15. 下列两种方案制备氢氧化铝:
下列两种方案制备氢氧化铝:
Ⅰ:2.7gAl$\stackrel{100mL稀盐酸}{→}$X溶液$\stackrel{氢氧化钠溶液}{→}$氢氧化铝
Ⅱ2.7gAl$\stackrel{100mL氢氧化钠溶液}{→}$Y溶液$\stackrel{稀盐酸}{→}$氢氧化铝
已知所用的稀盐酸与氢氧化钠溶液均为3mol/L.图是向X溶液与Y溶液中分别加入氢氧化钠溶液或稀盐酸时产生沉淀的质量与加入溶液体积之间的关系.(混合后体积变化忽略不计)下列说法正确的是( )
 下列两种方案制备氢氧化铝:
下列两种方案制备氢氧化铝:Ⅰ:2.7gAl$\stackrel{100mL稀盐酸}{→}$X溶液$\stackrel{氢氧化钠溶液}{→}$氢氧化铝
Ⅱ2.7gAl$\stackrel{100mL氢氧化钠溶液}{→}$Y溶液$\stackrel{稀盐酸}{→}$氢氧化铝
已知所用的稀盐酸与氢氧化钠溶液均为3mol/L.图是向X溶液与Y溶液中分别加入氢氧化钠溶液或稀盐酸时产生沉淀的质量与加入溶液体积之间的关系.(混合后体积变化忽略不计)下列说法正确的是( )
| A. | 在a曲线表示的是向Y溶液中加入稀盐酸 | |
| B. | 方案Ⅱ比方案Ⅰ生成更多的气体 | |
| C. | 在M点时,两方案中所得溶液的溶质质量分数相同 | |
| D. | M点以后,a、b两条曲线将重合为一条 |
2.已知:2Fe2++Br2=2Fe3++2Br-二现向1L某浓度的FeBr2溶液中,缓缓通入0.3molCl2至反应完全后,测出溶液中Br-和Cl-的物质的量浓度之比为1:2,则溶液中发生反应的离子方程式为( )
| A. | 2Fe2++Cl2═2Fe3++2Cl- | |
| B. | 2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| C. | 4Fe2++2Br-+3Cl2═Br2+4Fe3++6Cl- | |
| D. | 2Fe2++4Br-+3Cl2═2Br2+2Fe3++6Cl- |
12.下列关于化学用语表示正确的是( )
| A. | 四氯化碳电子式: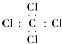 | |
| B. | 质子数35、中子数45的溴原子:${\;}_{35}^{80}$Br | |
| C. | 硫离子结构示意图: | |
| D. | HClO的结构式:H-Cl-O |
19.在一定温度下的2L密闭容器中,发生反应:2SO2(g)+O2(g)═2SO3(g);△H<0,n(O2)随时间的变化如表:
(1)反应在第五分钟时已达(填“已达”或“未达”)平衡状态.
(2)用SO2表示0?4min内该反应的平均速率为0.025mol•L-1•min-1.
(3)若升高温度,则SO2的反应速率变大(填“变大”、“变小”或“不变”).
| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| n(O2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.10 | 0.10 |
(2)用SO2表示0?4min内该反应的平均速率为0.025mol•L-1•min-1.
(3)若升高温度,则SO2的反应速率变大(填“变大”、“变小”或“不变”).
17.下列有机化合物中,刚开始滴入NaOH溶液会出现分层现象,用水浴加热后分层现象逐渐消失的是( )
| A. | 乙酸 | B. | 乙酸乙酯 | C. | 苯 | D. | 汽油 |

 .
. .
. .
. .
.