题目内容
【题目】铅的单质、氧化物、盐在现代工业中有着重要用途。
I.(1)铅能形成多种氧化物,如碱性氧化物PbO、酸性氧化物PbO2、类似Fe3O4的Pb3O4。Pb3O4与HNO3发生非氧化还原反应生成一种盐和一种铅氧化物,其反应的化学方程式为_____________________________。
II.以含铅废料(主要含Pb、PbO、PbO2、PbSO4)为原料制务高纯PbO,其主要流程如下:
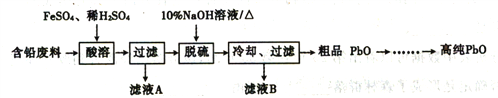
(2)“酸溶”时,在Fe2+催化下,Pb和PbO2反应生成1molPbSO4时转移电子的物质的量为____mol。
(3)已知:PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)=NaHPbO2(aq),其溶解度曲线如图所示:
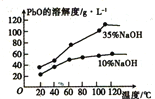
结合上述信息,完成由粗品PbO(所含杂质不溶于NaOH溶液)得到高纯PbO的操作:将粗品PbO溶解在一定量_________(填“35%”或“10%”)的NaOH溶液中,加热至110℃,充分溶解后,___________(填“趁热过滤”或“蒸发浓缩”),将滤液冷却结晶,过滤、洗涤并干燥得到高纯PbO固体。
(4)工业上利用硫化氢除去滤液A中少量的Pb2+,发生的反应为Pb2++H2S![]() PbS↓+2H+,该反应的平衡常数为_____________。(H2S的Ka1=1.5×10-7,Ka2=7.0×10-15,PbS的Ksp=8.4×10-28)
PbS↓+2H+,该反应的平衡常数为_____________。(H2S的Ka1=1.5×10-7,Ka2=7.0×10-15,PbS的Ksp=8.4×10-28)
(5)将粗品PbO溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液生成Pb的装置如图所示:

①阴极的电极反应式为________________________;
②当有2.07gPb生成时,通过质子交换膜的n(H+)=______________。
【答案】 Pb3O4+4HNO3=2Pb(NO3)2+PbO2+2H2O 1 35% 趁热过滤 1.25×106 PbCl42-+2e-=Pb+4Cl- 0.02mol
【解析】I.(1) Pb3O4与HNO3发生非氧化还原反应生成硝酸铅和二氧化铅,其反应的化学方程式为:Pb3O4+4HNO3=2Pb(NO3)2+PbO2+2H2O;正确答案:Pb3O4+4HNO3=2Pb(NO3)2+PbO2+2H2O。
II. (2) Pb+PbO2+2H2SO4= 2PbSO4+2H2O,每生成2molPbSO4,转移电子2mol,生成1molPbSO4时转移电子的物质的量为1mol;正确答案:1。
(3)根据PbO的溶解度曲线,提纯粗Pb的方法为将粗PbO溶解在NaOH溶液中,结合溶解度曲线特点可以知道浓度高的NaOH溶液和较高的温度,PbO的溶解度高,因此加热至较高温度,充分溶解,然后再高温下趁热过滤除去杂质,将滤液冷却结晶,过滤、洗涤并干燥得到高纯PbO固体;正确答案:35% ;趁热过滤。
(4)反应的平衡常数为c2(H+)/c(Pb2+)×c(H2S)= c(H+)×c(HS-)×c(H+)×c(S2-)/ c(H2S) ×c(HS-) ×c(S2-)= Ka1×Ka2/Ksp=1.5×10-7×7.0×10-15/8.4×10-28=1.25×106;正确答案:1.25×106。
(5)①电解池的阴极发生还原反应:PbCl2-4得电子还原为Pb,电极反应式为PbCl42-+2e-=Pb+4Cl-;正确答案:PbCl42-+2e-=Pb+4Cl-。
②当有2.07gPb(即0.01mol)生成时,根据PbCl42-+2e-=Pb+4Cl-反应可知转移电子0.02 mol,通过质子交换膜的n(H+)=0.02mol;正确答案:0.02mol。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案