题目内容
以下能级符号不正确的是 ( )
| A.3s | B.3f | C.3d | D.3p |
B
解析试题分析:第三电子层只有s、p、d三种能级。所以能级符号不正确是3f。选项为B.
考点:考查原子结构的认识的表示的知识。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示。若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是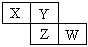
| A.X的气态氢化物比Y的稳定 |
| B.W的最高价氧化物对应水化物的酸性比Z的强 |
| C.Z的非金属性比Y的强 |
| D.X与Y形成的化合物都易溶于水 |
下列说法正确的是( )
| A.Cl、Br、I的非金属性逐渐减弱,HCl、HBr、HI水溶液的酸性逐渐减弱 |
| B.短周期元素形成离子后,最外层均达8电子稳定结构 |
| C.多电子原子中,在离核较近的区域运动的电子能量较低 |
| D.Cl、 S、P得电子能力和它们相应的最高价氧化物对应水化物的酸性均依次增强 |
对充有氖气的霓虹灯管通电,灯管发出红色光。产生这一现象的主要原因( )
| A.在电流的作用下,氖原子与构成灯管的物质发生反应 |
| B.电子由基态向激发态跃迁时吸收除红光以外的光线 |
| C.氖原子获得电子后转变成发出红光的物质 |
| D.电子由激发态向基态跃迁时以光的形式释放能量 |
下列各组物质的性质比较,正确的是
| A.酸性:HClO4>H3PO4>H2SO4 |
| B.氢化物稳定性:H2S>HF>H2O |
| C.碱性:Al(OH)3>Mg(OH)2>NaOH |
| D.氧化性:F2 > Cl2 > Br2 > I2 |
下列说法中,不符合ⅦA族元素性质特征的是
| A.从上到下原子半径逐渐减小 | B.易形成-1价离子 |
| C.最高价氧化物的水化物显酸性 | D.从上到下氢化物的稳定性依次减弱 |
氯元素在自然界有35Cl和37Cl两种同位素,在计算式:34.969×75.77%+36.966×24.23% =35.453中
| A.75.77%表示35Cl的质量分数 |
| B.24.23%表示35Cl的丰度 |
| C.35. 453表示氯元素的相对原子质量 |
| D.36.966表示37Cl的质量数 |
.我国稀土资源丰富。下列有关稀土元素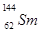 与
与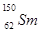 的说法正确的是
的说法正确的是
A.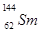 与 与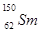 互为同位素 互为同位素 |
B.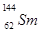 与 与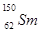 的质量数相同 的质量数相同 |
C.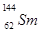 与 与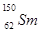 是同一种核素 是同一种核素 |
D.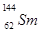 与 与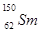 的核外电子数和中子数均为62 的核外电子数和中子数均为62 |
短周期元素X、Y、Z、W在元素周期表中的相对位置如右图所示,其中Z的核电荷数是Y的2倍。下列判断不正确的是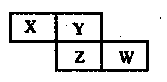
| A.最简单气态氢化物的热稳定性:Y>Z |
| B.最高价氧化物的水化物的酸性:X<W |
| C.X元素的氢化物与其最高价氧化物的水化物能形成离子化合物 |
| D.Y的氢化物沸点远高于Z的氢化物,是因为H-Y键的键能高于H-Z键的键能 |