题目内容
【题目】氮(N)、磷(P)、砷(As)等都是VA族元素,该族元素的化合物在研究和生产中有许多重要用途。回答下列问题:
(1)As原子的价电子排布式为____________。
(2)P和S是同一周期的两种元素,P的第一电离能比S大,原因是________________。
(3)NH4+中H—N—H的键角比NH3分子中的键角________(填“大”或“小”),原因是____________。
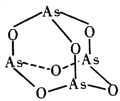
(4)NaAsO4中含有的化学键类型包括__________;AsO43-的空间构型为_____________;As4O6的分子结构如下图所示,则在该化合物中As原子的杂化方式是____________。
(5)2017年1月27日,我国科学家在《Science》杂质上发表论文,在全氮阴离子盐合成上取得重大进展,首次制得试问下稳定,含有N5-离子的盐(具有超高能量密度的化合物),N5-离子中氮元素的平均化合价为_____。
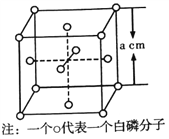
(6)白磷(P)的晶体属于分子晶体,其晶胞结构如下图(小圆圈表示白磷分子)。该晶胞中含有的P原子数为_______;已知该晶胞的边长为a cm,阿伏加德罗常数为NAmol-1,则该晶体的密度为_____g·cm-3(用含有NA的式子表示)
【答案】 4s24p3 P的3p轨道是半充满状态,比较稳定,所以第一电离能比硫的大 大 NH![]() 中的氮原子上均为成键电子,而NH3分子中的氮原子上有一对孤对电子,孤对电子和成键电子之间的排斥力强于成键电子和成键电子之间的排斥力 离子键、共价键 正四面体 sp3 -
中的氮原子上均为成键电子,而NH3分子中的氮原子上有一对孤对电子,孤对电子和成键电子之间的排斥力强于成键电子和成键电子之间的排斥力 离子键、共价键 正四面体 sp3 -![]() 16
16 ![]()
【解析】(1)As位于第四周期第VA族,原子的价电子排布式为4s24p3。
(2)P和S是同一周期的两种元素,P的第一电离能比S大,原因是P的3p轨道是半充满状态,比较稳定,所以第一电离能比硫的大。
(3)NH4+中H—N—H的键角比NH3分子中的大,原因是NH![]() 中的氮原子上均为成键电子,而NH3分子中的氮原子上有一对孤对电子,孤对电子和成键电子之间的排斥力强于成键电子和成键电子之间的排斥力。
中的氮原子上均为成键电子,而NH3分子中的氮原子上有一对孤对电子,孤对电子和成键电子之间的排斥力强于成键电子和成键电子之间的排斥力。
(4)NaAsO4中含有的化学键类型包括离子键、共价键;AsO43-中中心原子的价电子对数为4对,所以其空间构型为正四面体;As4O6中As原子连接3根化学键,所以杂化方式是sp3。
(5)根据化合价规则,5个N原子总共为-1价,所以N5-离子中氮元素的平均化合价为- ![]() 价。
价。
(6)每1个白磷分子含4个P原子,该晶胞中含有4个白磷分子,所以P原子数为16;晶体的密度=晶胞质量÷晶胞体积=![]() 。
。

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案