题目内容
(14分)为探究实验室制乙烯及乙烯和溴水的加成反应。甲同学设计了如图所示的实验装置,并进行了实验。当温度升至170℃左右时,有大量气体产生,产生的气体通入溴水中,溴水的颜色迅速褪去。甲同学认为达到了实验目的。

乙同学仔细考察了甲同学的整个实验过程,发现当温度升到100℃左右时,无色液体开始变色,到160℃左右时,混合液全呈黑色,在170℃超过后生成气体速度明显加快,生成的气体有刺激性气味。由此他推出,产生的气体中应有杂质,可能影响乙烯的检出,必须除去。据此回答下列问题:
(1)写出甲同学实验中两个反应的化学方程式:____________________________________、
____________________________________。
(2)乙同学观察到的黑色物质是__________,刺激性气体是__________。乙同学认为刺激性气体的存在就不能认为溴水褪色是乙烯的加成反应造成的。
原因是(用化学方程表示):__________________。
(3)丙同学根据甲乙同学的分析,认为还可能有CO、CO2两种气体产生。为证明CO存在,他设计了如下过程(该过程可把实验中产生的有机产物除净):发现最后气体经点燃是蓝色火焰,确认有一氧化碳。

①设计装置a的作用是_____________________________________________
②浓溴水的作用是_________________________________________________,
稀溴水的作用是___________________________________________________。

乙同学仔细考察了甲同学的整个实验过程,发现当温度升到100℃左右时,无色液体开始变色,到160℃左右时,混合液全呈黑色,在170℃超过后生成气体速度明显加快,生成的气体有刺激性气味。由此他推出,产生的气体中应有杂质,可能影响乙烯的检出,必须除去。据此回答下列问题:
(1)写出甲同学实验中两个反应的化学方程式:____________________________________、
____________________________________。
(2)乙同学观察到的黑色物质是__________,刺激性气体是__________。乙同学认为刺激性气体的存在就不能认为溴水褪色是乙烯的加成反应造成的。
原因是(用化学方程表示):__________________。
(3)丙同学根据甲乙同学的分析,认为还可能有CO、CO2两种气体产生。为证明CO存在,他设计了如下过程(该过程可把实验中产生的有机产物除净):发现最后气体经点燃是蓝色火焰,确认有一氧化碳。

①设计装置a的作用是_____________________________________________
②浓溴水的作用是_________________________________________________,
稀溴水的作用是___________________________________________________。
(14分)(1) CH3CH2OH 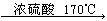 CH2==CH2↑ + H2O
CH2==CH2↑ + H2O
CH2==CH2 + Br2 Br-CH2CH2-Br (2×2分)
Br-CH2CH2-Br (2×2分)
(2) C(1分) SO2(1分) Br2 + SO2 + 2H2O ="=" 2HBr + H2SO4 (2分)
(3)①安全装置,防倒吸(2分)
②吸收乙烯、二氧化硫气体(2分) 检验乙烯、二氧化硫气体是否除净(2分)
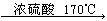 CH2==CH2↑ + H2O
CH2==CH2↑ + H2O CH2==CH2 + Br2
 Br-CH2CH2-Br (2×2分)
Br-CH2CH2-Br (2×2分)(2) C(1分) SO2(1分) Br2 + SO2 + 2H2O ="=" 2HBr + H2SO4 (2分)
(3)①安全装置,防倒吸(2分)
②吸收乙烯、二氧化硫气体(2分) 检验乙烯、二氧化硫气体是否除净(2分)
(1)乙醇在浓硫酸的作用下发生消去反应生成乙烯,乙烯含有碳碳双键,能和溴水发生加成反应。有关的方程式为CH3CH2OH 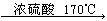 CH2==CH2↑ + H2O、CH2==CH2 + Br2
CH2==CH2↑ + H2O、CH2==CH2 + Br2 Br-CH2CH2-Br。
Br-CH2CH2-Br。
(2)由于浓硫酸具有脱水性,所以能使乙醇炭化,因此黑色物质是碳。又因为浓硫酸还具有强氧化性,能氧化碳生成CO2、SO2和水,即刺激性气味的气体是SO2。SO2具有还原性,而溴水具有氧化性,能把SO2氧化生成硫酸,方程式为Br2 + SO2 + 2H2O ="=" 2HBr + H2SO4。
(3)①由于CO2或SO2都易被氢氧化钠吸收,有可能造成液体倒流,所以设计a装置的作用是防倒吸的,即起安全瓶的作用。
②为检验CO,就需要除去SO2、乙烯,所以浓溴水是为了吸收乙烯、二氧化硫气体。而为了检验二者是否除净,还需要再利用稀溴水来检验乙烯、二氧化硫气体是否除净。
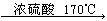 CH2==CH2↑ + H2O、CH2==CH2 + Br2
CH2==CH2↑ + H2O、CH2==CH2 + Br2 Br-CH2CH2-Br。
Br-CH2CH2-Br。(2)由于浓硫酸具有脱水性,所以能使乙醇炭化,因此黑色物质是碳。又因为浓硫酸还具有强氧化性,能氧化碳生成CO2、SO2和水,即刺激性气味的气体是SO2。SO2具有还原性,而溴水具有氧化性,能把SO2氧化生成硫酸,方程式为Br2 + SO2 + 2H2O ="=" 2HBr + H2SO4。
(3)①由于CO2或SO2都易被氢氧化钠吸收,有可能造成液体倒流,所以设计a装置的作用是防倒吸的,即起安全瓶的作用。
②为检验CO,就需要除去SO2、乙烯,所以浓溴水是为了吸收乙烯、二氧化硫气体。而为了检验二者是否除净,还需要再利用稀溴水来检验乙烯、二氧化硫气体是否除净。

练习册系列答案
相关题目


