题目内容
某温度下HF的电离常数Ka=3.3×10-4 mol·L-1,CaF2的溶度积常数Ksp=1.46×10-10(mol·L-1)3。在该温度下取浓度为0.31 mol·L-1的HF与浓度为0.002 mol·L-1的CaCl2溶液等体积混合。下列说法正确的是( )
| A.该温度下,0.31 mol·L-1的HF溶液的pH=2 |
| B.升高温度或增大浓度,HF的电离平衡常数都将增大 |
| C.两溶液混合不会产生沉淀 |
| D.向饱和的CaF2溶液中加水后,c(Ca2+)一定比加水前减小 |
A
解析试题分析:A、电离常数Ka(HF)=3.3×10-4,HF为弱电解质,不能完全电离,25℃时,0.31mol/LHF溶液中c(H+)=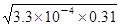 =1×10-2mol/L,pH=1,故A正确;B、电离常数只受温度的影响,不随浓度的变化而变化,故B错误;C、0.31 mol/L的HF溶液中c(H+)=c(F-)=1×10-2mol/L。故C错误;在该温度下取浓度为0.31 mol·L-1的HF与浓度为0.002 mol·L-1的CaCl2溶液等体积混合后c(F-)=0.5×10-2mol/L,c(Ca2+)=0.001mol/L,则c2(F-)×c(Ca2+)=(0.5×10-2)2×0.001=2.5×10-8>1.46×10-10,因此该体系中有CaF2沉淀产生,故C不正确。D、向饱和的CaF2溶液中加水后,溶液还可能是饱和的,所以c(Ca2+)不一定比加水前减小,D不正确,答案选A。
=1×10-2mol/L,pH=1,故A正确;B、电离常数只受温度的影响,不随浓度的变化而变化,故B错误;C、0.31 mol/L的HF溶液中c(H+)=c(F-)=1×10-2mol/L。故C错误;在该温度下取浓度为0.31 mol·L-1的HF与浓度为0.002 mol·L-1的CaCl2溶液等体积混合后c(F-)=0.5×10-2mol/L,c(Ca2+)=0.001mol/L,则c2(F-)×c(Ca2+)=(0.5×10-2)2×0.001=2.5×10-8>1.46×10-10,因此该体系中有CaF2沉淀产生,故C不正确。D、向饱和的CaF2溶液中加水后,溶液还可能是饱和的,所以c(Ca2+)不一定比加水前减小,D不正确,答案选A。
考点:考查溶度积常数、电离平衡常数的有关判断和应用

 科学实验活动册系列答案
科学实验活动册系列答案已知同温度下溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2;就溶解或电离出S2-的能力而言,FeS>H2S>CuS,则下列离子方程式错误的是
| A.Mg2++2HCO3-+2Ca2++4OH- = Mg(OH)2↓+2CaCO3↓+2H2O |
| B.Cu2++H2S = CuS↓+2H+ |
| C.Zn2++S2-+2H2O = Zn(OH)2↓+H2S↑ |
| D.FeS+2H+ = Fe2++H2 S↑ |
对于室温下pH=3的醋酸,下列叙述正确的是
| A.加水稀释后,醋酸的电离程度增大,溶液的导电性增强 |
| B.c(H+)=c(CH3COO-)+c(OH-) |
| C.加入少量醋酸钠固体后,恢复至室温,溶液中c(CH3COO-)?c(H+)/c(CH3COOH)不变 |
| D.与等体积pH=11的NaOH溶液混合后,pH=7 |
下列叙述正确的是
| A.电解精炼铜时,转移1mol电子,阳极上溶解的铜原子数必为0.5NA |
| B.常温下,4.4gCO2和N2O混合物中所含有的原子数为0.3×6.02×1023 |
| C.等体积0.2mol·L-1HCl溶液与0.05mol·L-1Ba(OH)2溶液混合后,溶液的pH=1 |
| D.溶液中由水电离出的c(H+)=1×10-12mol/L,SO42-、NO3-、Fe2+、Mg2+能大量共存 |
下列说法正确的是
A.已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+,加少量烧碱溶液可使溶液中 CH3COO-+H+,加少量烧碱溶液可使溶液中 值增大。 值增大。 |
B.25℃时,向水中加入少量固体CH3COONa,水的电离平衡:H2O H++OH-逆向移动,c(H+)降低 H++OH-逆向移动,c(H+)降低 |
| C.取c(H+)="0.01" mol·L-1的盐酸和醋酸各100 mL,分别稀释2倍后,再分别加入0.03 g锌粉,在相同条件下充分反应,醋酸与锌反应的速率大 |
| D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液中:c(Na+)<c(NO3-) |
下列关于常温下电解质溶液的叙述中,正确的是
| A.碳酸氢铵溶液和足量的氢氧化钠溶液混合的离子反应:HCO3-+OH-=CO32-+H2O |
| B.等物质的量浓度、等体积的氨水和盐酸混合后,c(H+)+ c(NH4+)= c(Cl-)+ c(OH-) |
| C.等物质的量浓度的NH4Cl溶液和NH3·H2O溶液,溶液中c(NH4+)前者小于后者 |
| D.25℃时,pH=8的0.1mol·L-1NaX溶液中由水电离出的c (OH-)=1×10-8mol·L-1 |
室温下向10 mL pH = 3的醋酸溶液中加水稀释后,下列说法正确的是( )
| A.溶液中导电粒子的数目减少 |
| B.溶液中C(CH3COO-)/C(CH3COOH).c(OH-)不变 |
| C.醋酸的电离程度增大,c(H+)亦增大 |
| D.再加入10 mL pH = 11的NaOH溶液,混合液pH=7 |
(9分)下表是不同温度下水的离子积常数:
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | KW | 1×10-12 |
(1)若25℃<t1<t2,则KW__________1×10-14(填“>”、“<”或“=”),判断的理由是 。
(2)25℃ 下,将pH=13的氢氧化钠溶液V1 L与pH=1的稀盐酸V2 L混合(设混合后溶液的体积为:V1+V2),所得混合溶液的pH=2,则V1 : V2=__________。
(3)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 (填“酸性”、“中性”或“碱性”),溶液中c(Na+) c(CH3COO-)(填“>”、“=”或“<”)。
(4)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 性(填“酸”、 “中”或“碱”),溶液中c(Na+) c(CH3COO-)[填“>”、“=”或“<”] 。